器官発生工学(磯谷研究室)
-
研究室ホームページ
- https://bsw3.naist.jp/isotani/
-
全学オンラインセミナー
2022年度に開催されたBio Discovery Session(全学オンラインセミナー)のアーカイブ動画の一覧です。 - Bio Discovery Session
-
Webメディア
NAIST Edge BIOは、奈良先端科学技術大学院大学 バイオサイエンス領域 の各研究室で取り組んでいる「最先端」の研究プロジェクトや研究成果について、研究者だけではなく受験生や一般の方にも分かりやすく紹介するためのWebメディアです。 - NAIST Edge BIO 第6回、第31回
研究・教育の概要
哺乳類において、精子と卵子が融合した受精胚は、8細胞期胚まで、すべての細胞に分化することができる万能性を持ち、着床直前の胚盤胞期になると、将来、胎盤になる栄養膜細胞と、様々な組織や臓器へと分化する内部細胞塊に運命が分かれます。内部細胞塊から樹立された胚性幹細胞(ES細胞)は、胎盤組織以外であれば、生殖細胞を含むどんな細胞にでも分化できる多能性を持ち、この性質は、再生医療研究を大きく後押しし、誘導型多能性幹細胞(iPS細胞)の発見にも繋がりました。初期胚、ES/iPS細胞と発生工学技術を組み合わせた、動物モデルを通して、再生医療に繋がる基礎研究を目指します。
主な研究テーマ
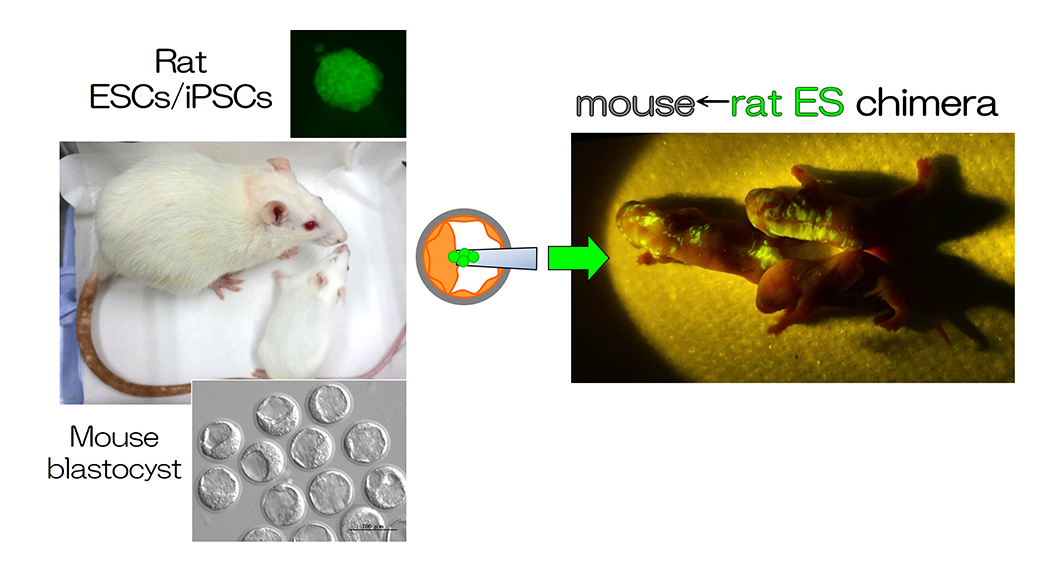
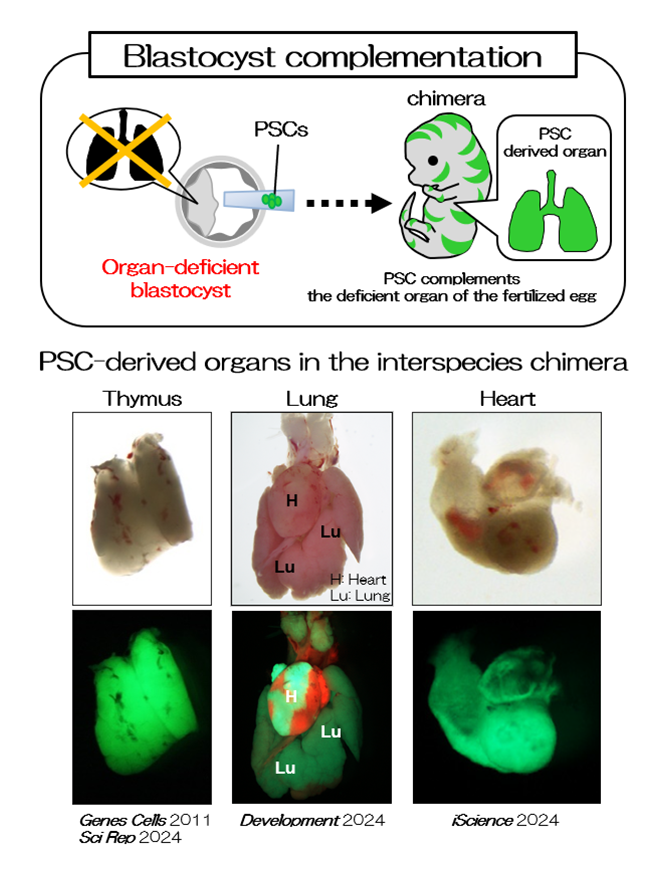
異種キメラを用いた臓器形成モデル
胚盤胞とES細胞やiPS細胞といった多能性幹細胞 (PS細胞)を用いれば、マウスとラットの細胞を個体の中に合わせ持つ異種キメラが誕生させることができます(図1、図2、論文 [1-3, 7-9])。この異種間キメラの作製方法を応用して臓器を欠損したマウスの胚盤胞とラットのPS細胞を用いると、欠損した臓器がラットの細胞で構築されます。つまり、異種キメラの系を用いれば、PS細胞から、複雑な3次元構造を持つ臓器を作ることができます (図2、論文 [1-3, 9])。また、マウスの胚にラットのES細胞を注入した異種キメラの精巣内には、マウスだけでなく、ラットの精子もできますが、これらの精子は同種の卵子と受精させると、次世代が誕生することが分かっています (論文 [7, 8])。このように、異種キメラの体内でPS細胞由来の臓器・組織、細胞を作製し、その機能を明らかにすることは、再生医療に結びつけるためにも、今後の重要な課題になります。異種キメラの系を用いて、様々な臓器形成モデルの確立を試み、臓器・組織、細胞が正常に機能するために必要な要因を明らかにしていきます。
新規動物モデルの開発
近年、次世代遺伝子改変技術として注目されているゲノム編集技術(CRISPR/Casシステムなど)を用いれば、簡単に遺伝子破壊動物を作製できるようになりました。この技術をES細胞(または、iPS細胞)と組み合わせば、より複雑な遺伝子改変を行えるようになります。2細胞期胚のそれぞれの割球を電気融合させた四倍体胚は、胎盤系列の細胞には分化し機能しますが、胎児の体を構成する細胞にはなりません。一方、ES細胞は、胎児の体を構成するどんな細胞にも分化しますが、唯一、胎盤系列の細胞には分化することができません。ES細胞を遺伝子改変した後、四倍体胚にインジェクションすると、ES細胞からのみなる胎児や産仔を得ることができます。この四倍体胚補完法は、遺伝子改変の表現型をF0で解析可能なハイスループットな手法も駆使して研究しています(図3、論文 [3, 5, 6])。
このように単に遺伝子改変を行ったヒトの疾患モデル動物だけでなく、遺伝子工学・細胞工学・生殖工学を駆使して生命科学研究のブレイク・スルーに繋がるような新たな動物モデルの開発を目指します。
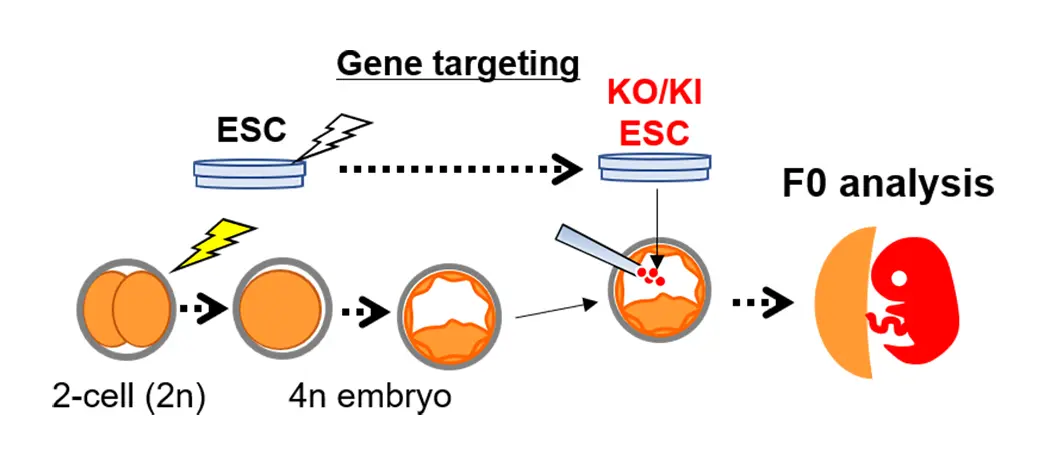
(図3) 四倍体胚補完法を用いたF0解析
遺伝子ノックアウト(KO)や、遺伝子ノックイン(KI)をしたES細胞を4倍体の受精卵に注入すると、胎児・産仔はES細胞由来の細胞からのみ構成される。このため、遺伝子の機能を次世代を経ずに解析することができる。
主な発表論文・著作
- Yuri et al., iScience, 27, 111414, 2024
- Lim et al., Sci Rep, 14, 10636, 2024
- Yuri S et al., Development, 151, dev202081, 2024
- Sari GP et al., Sci Rep, 12, 21985, 2022
- Hirata et al., Exp Anim, 71, 82-89, 2022
- Kishimoto et al., Sci Rep, 11, 8297, 2021
- Isotani et al., Biol Reprod, 97, 61-68, 2017
- Isotani et al. Sci Rep, 6, 24215, 2016
- Isotani et al. Genes Cells, 16, 397-405, 2011
- Isotani et al. Proc Natl Acad Sci U S A, 102, 4039-4044, 2005
(こちらのリンクはすべて外部サイトへ遷移します![]() )
)
 奈良先端科学技術大学院大学
奈良先端科学技術大学院大学