2025.06.02
異種間キメラ動物の体内で多能性幹細胞由来の心臓をつくる
器官発生工学研究室・准教授・磯谷 綾子
- 要旨
- 臓器を欠損する遺伝型を持つ動物の受精卵に多能性幹細胞を注入して、多能性幹細胞由来の臓器を作る胚盤胞補完法は、臓器移植の課題であるドナー臓器不足と免疫拒絶を解決する方法として注目されています(1-4)。私たちは心臓を欠損する遺伝型を持つマウスモデルの受精卵にラットES細胞を注入して、ラットの心臓を異種間キメラ動物の体内で作ることに成功しました。心臓を欠損したマウスは胎生8.5日までに致死になるのに対し、ラットの心臓を持つ異種間キメラ動物は胎生12.5日まで生存したものの、それ以降に致死となることが分かりました。この結果は、ラットの心臓を異種間キメラ体内で作ることはできましたが、胎児期のある時点以降で生存に必要な機能を果たせなくなることを示唆しました(5)。胚盤胞補完法を使って、異種の多能性幹細胞由来の移植可能な心臓を作製するには解決するべき問題がまだあり、この障壁を乗り越えることで、将来的には心臓ドナーの作製につながることが期待されます。
- 主要関連論文
- Yuri S, Arisawa N, Kitamuro K, Isotani A. (2024) Blastocyst complementation-based rat-derived heart generation reveals cardiac anomaly barriers to interspecies chimera development. iScience 27:111414. doi: 10.1016/j.isci.2024.111414.
1.はじめに
臓器移植は、深刻な臓器不全の抜本的な治療方法ですが、ドナー臓器は移植を待つ患者に対して、圧倒的に不足しているのが現状です。また、運良く臓器移植をする事ができてもドナー臓器に対する免疫応答を抑制するために一生涯、免疫抑制剤の投薬が必要で、感染症の重篤化や発がんのリスクを伴います。この臓器移植の大きな課題である移植用ドナー臓器不足と、移植後の免疫拒絶の両方を解決する手段として、臓器欠損の遺伝型をもつ受精卵にES細胞やiPS細胞といった多能性幹細胞 (PS細胞) を注入して、PS細胞由来の臓器を動物体内で作る胚盤胞補完法が注目されています (1-4)。
私たちは、血液によって酸素や栄養を全身に循環させるポンプとして機能し、生命維持に必要不可欠な心臓に着目しました。成人の心筋細胞は再生能力が乏しく、虚血性心疾患が世界中でも主要な死因となっています。このような心疾患が重篤化し末期心不全になると心臓移植しか抜本的な治療法はありませんが、臓器の提供が限られていることが大きな問題となっています。私たちは、胚盤胞補完法によって多能性幹細胞由来の心臓を作ることを目的として、新たに心臓欠損モデルマウスを作成して胚盤胞補完法に適しているかどうかを評価し、異種であるラットの多能性幹細胞を注入して、心臓形成能について検討しました(5)。
2.逆胚盤胞補完法を用いた、胚盤胞補完法に適した心臓欠損モデルの評価
まず、心臓を欠損するモデルマウスの作製にあたり、心臓の発生に重要な働きをするMesp1と、Mesp1欠損マウスでは、その機能を補完するように発現して働くといわれているMesp2(6)に注目しました。私たちは、これらの遺伝子欠失による心臓欠損モデルが胚盤胞補完法に適しているかどうかを、逆胚盤胞補完法という方法で評価することにしました。
逆胚盤胞補完法は、蛍光タンパク質を全身性に発現するトランスジーンを持つES細胞に遺伝子改変を行い、野生型の受精卵に注入することで、遺伝子改変されたES細胞の分化の挙動を蛍光タンパク質の発現によって追跡する方法です。今回のケースであれば、心臓欠損モデルに遺伝子改変されたES細胞由来の細胞、すなわち蛍光タンパク質を発現する細胞が心臓に寄与していなければ、胚盤胞補完法に適した遺伝型であると判断できます(7)。
そこで、赤色蛍光タンパク質(RFP)を発現するマウスES細胞を用いて、Mesp1欠失したES細胞(Mesp1-KO ES細胞)と、Mesp1とMesp2両方を欠失した2重欠損ES細胞(Mesp1/2-DKO ES細胞)を樹立しました。これら樹立したES細胞を野生型のマウス受精卵に注入し、心臓への寄与を調べたところ、Mesp1-KOの細胞は、心臓への寄与が認められましたが、Mesp1/2-DKOの細胞は、心房の一部を除き心臓を構成するほとんどの細胞に寄与しないことが分かりました(図1)。また、心臓以外の組織でのMesp1/2-DKO細胞と野生型細胞の割合(キメリズム)から、野生型の細胞が20%以上寄与すれば、心臓が形成されることが分かりました。
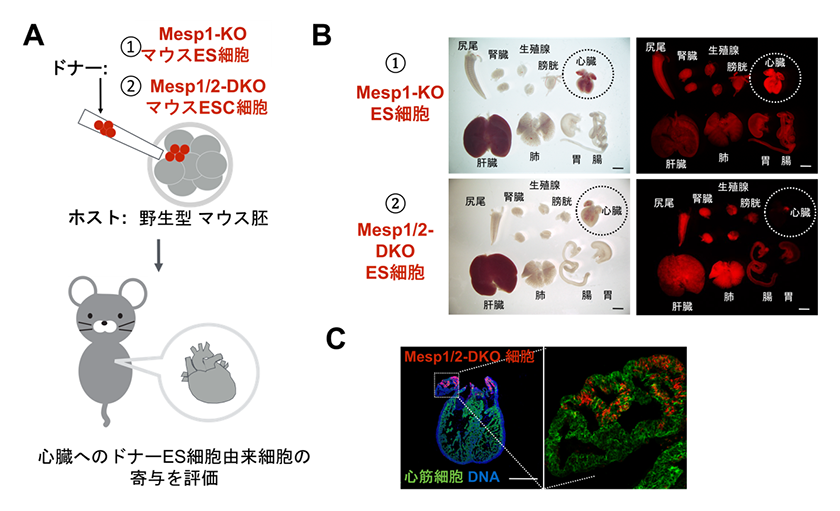
図1.A:逆胚盤胞補完法の概要図
B:Mesp1-KO ES細胞または、Mesp1/2-DKO ES細胞を野生型に注入したキメラの臓器。RFPによりES細胞由来細胞を同定できる。
C:Mesp1/2-DKO ES細胞由来細胞 (RFP陽性)は心房の一部に寄与するが、心臓の他の細胞種には寄与しない。
3.胚盤胞補完法を異種間キメラに適用したラット多能性幹細胞由来心臓の作製
逆胚盤胞補完法によりMesp1/2-DKOの遺伝型の細胞は心臓にほとんど寄与しないことが分かりましたので、CRISPR/Cas9システムを用いて受精卵を遺伝子改変し、Mesp1/2-DKOヘテロ変異のマウス系統を樹立しました。
このヘテロ変異マウス同士を交配させて得た受精卵に、異種であるラットES細胞を注入し、マウスとラットの細胞が混ざり合った異種間キメラの体内で、ラット由来のES細胞が心臓に発生分化するかどうかを調べました。その結果、Mesp1/2-DKOマウスの胎児は、心臓が形成されないため胎生8.5日までに致死となりましたが、異種間キメラの中には胎生12.5日目まで生存する個体が認められ、これらの個体にはラットES細胞に由来する心臓が形成されていることが分かりました(図2)。このことは、胚盤胞補完法により、作られたラット由来の心臓が機能したことを意味します。また、逆胚盤胞補完法によって観察された心房細胞へのMesp1/2-DKOマウス細胞の部分的な寄与は、異種間キメラではほとんど見られないことも分かりました。これは、異種間キメラにおいて、ラットの細胞が心臓に発生・分化しやすいということが関係しているものと推測されました(8)。
しかし、残念ながら、ラットES細胞に由来する心臓は、胎生13.5日以降の胎児が発育するのに十分な働きを持たず、致死になることも分かりました。
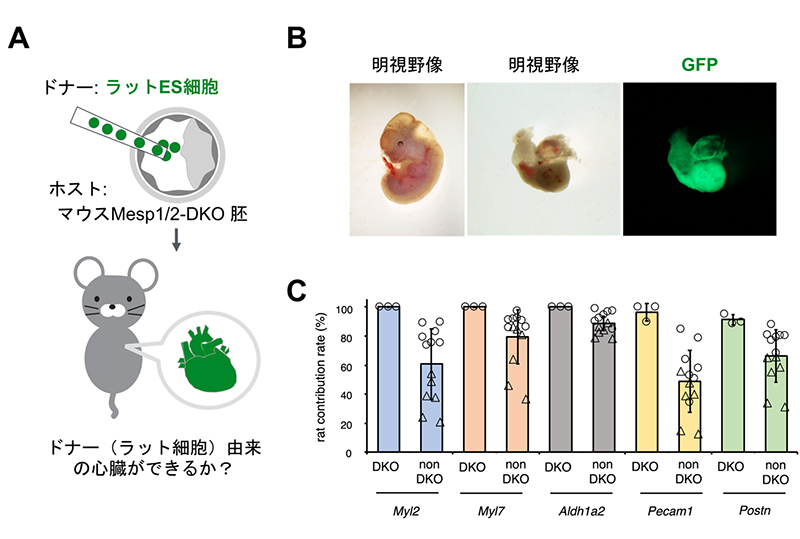
図2.A:胚盤胞補完法の概要図
B:異種間キメラの胎児(右写真)、ラットの心臓(中央、左写真)
C:心臓におけるラット由来細胞の寄与率。Myl2:心房、Myl7:心室、Aldh1a2:心外膜、Pecam1:血管内皮、Postn:繊維芽様細胞
4.おわりに
今回の研究では、心臓のほぼすべての細胞に寄与しない胚盤胞補完法に適した心臓欠損モデルマウスを新たに作製し、異種間キメラ動物の体内でラット多能性幹細胞由来の心臓を作り出せることを明らかにしました。しかしながら、作り出された心臓は胎児が発育する途中で十分に機能をもたなくなることが明らかとなりました。これは、胚盤胞補完法により、機能的な異種の心臓を作製するためには、種特異的な心臓の発生・分化のメカニズムを考慮する必要性があることを示しました。ドナーとなる機能的な心臓の作製にはさらなる研究が必要ですが、マウスとラットの異種間キメラ体内でラット多能性幹細胞由来の心臓を作れることを示せたことは、将来的に、ヒトと動物間での胚盤胞補完法による心臓作製の可能性を示すものであり、再生臓器の移植医療の発展に貢献するものと期待されます。
参考文献
- Kobayashi T et al., (2010) Sep 3;142(5):787-99.
- Isotani A et al., (2011) Apr;16(4):397-405.
- Wu J et al., (2017) Jan 26;168(3):473-486.e15.
- Yamaguchi T et al., (2017) Feb 9;542(7640):191-196.
- Yuri S et al., (2024) Nov 18;27(12):111414.
- Kitajima S et al., (2000) Aug;127(15):3215-26.
- Yuri Set al., (2024) Jan 1;151(1):dev202081.
- Yamaguchi T et al., (2018) Oct 16;8(1):15289.
磯谷 綾子 NAIST Edge BIO, 0031. (2025)

