植物成長制御 (梅田研究室)
-
研究室ホームページ
- https://bsw3.naist.jp/umeda/
-
全学オンラインセミナー
2022年度に開催されたBio Discovery Session(全学オンラインセミナー)のアーカイブ動画の一覧です。 - Bio Discovery Session
-
Webメディア
NAIST Edge BIOは、奈良先端科学技術大学院大学 バイオサイエンス領域 の各研究室で取り組んでいる「最先端」の研究プロジェクトや研究成果について、研究者だけではなく受験生や一般の方にも分かりやすく紹介するためのWebメディアです。 - NAIST Edge BIO 第2回、第27回
研究・教育の概要
植物は一生を通じて器官形成を続けます。これは、胚発生初期に器官形成を終える動物とは大きく異なる特徴です。私達は、植物が癌も作らず組織を維持・再生する仕組み、環境ストレスに応答した細胞分裂の制御機構、DNA倍加により器官サイズを大きくするメカニズムについて解析し、植物が変動する環境下でどのように成長を続けられるのか、その背景にある制御基盤を理解しようとしています。これらの研究は、植物特有の生存・成長様式を理解するのに役立つだけでなく、食料やバイオマスの増産に繋がるような植物の成長改変技術を開発する上でも非常に重要です。
主な研究テーマ
植物がもつ組織の維持・再生機構
植物は旺盛な器官形成能力をもつとともに、傷がつくとすぐに組織を再生する能力ももっています。しかし、動物のように細胞が癌化することはありません。私達は、植物がゲノムを安定的に維持することにより長寿命性を発揮するメカニズムを解明しようとしています。また、細胞死が起きた後に隣接細胞が分裂を活性化させたり(図1)、過剰な細胞増殖が自律的に収束する過程を明らかにすることで、脳や神経をもたない植物が柔軟に組織を維持・再生できる分子基盤を理解しようとしています。
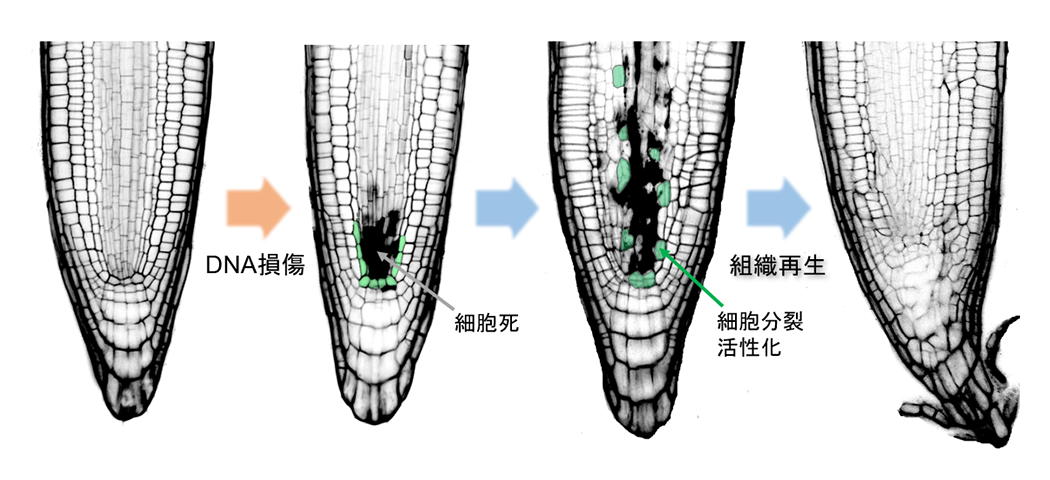
(図1) DNA損傷後の根の組織再生
シロイヌナズナの根がDNA損傷を受けると、幹細胞が細胞死を起こす。その後、死細胞の隣接細胞で分裂の活性化が起こり、組織が再生される。緑色の細胞が、死細胞の周りで分裂を活性化させている隣接細胞。
環境ストレスに応答した細胞分裂の制御機構
移動することができない植物は、環境ストレスに曝されると細胞分裂を一時停止させ、ストレス対処にエネルギーを消費する戦略をとります。私達は、植物が様々な環境ストレスに応答して細胞周期をG2期で停止させる仕組みを発見しました(図2)。このチェックポイント機構を発動させるシグナル伝達経路を解明することにより、野外で複合的なストレスに曝されても成長を止めない、スーパーストレス耐性植物を作出しようとしています。
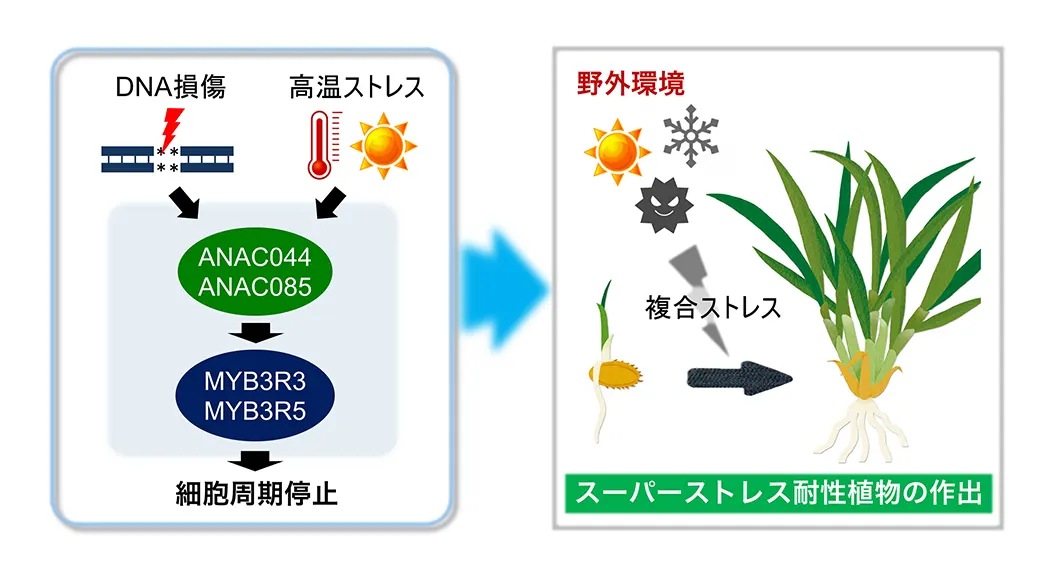
(図2) 環境ストレスに応答した細胞分裂の停止機構
DNA損傷や高温ストレスを受けると、植物は独自の転写カスケードを活性化し、細胞周期をG2期で停止させる。この制御系を改変することにより、複合ストレス下でも成長を続けることができる作物の作出が期待される。
DNA倍加の誘導機構
多くの植物は、細胞分裂を終えた後にDNA倍加(DNA複製のみを繰り返すことでDNA量を倍々に増やす現象)を起こし、細胞・器官サイズを大きくします。最近の私達の研究により、クロマチン構造の変化がDNA倍加誘導に重要であることが明らかになってきました(図3)。そこで、クロマチン動態とDNA倍加との関連性について解析するとともに、樹木のようなDNA倍加を起こさない植物種でDNA倍加を誘発する技術を開発し、地球規模の食料・バイオマスの増産に貢献したいと考えています。
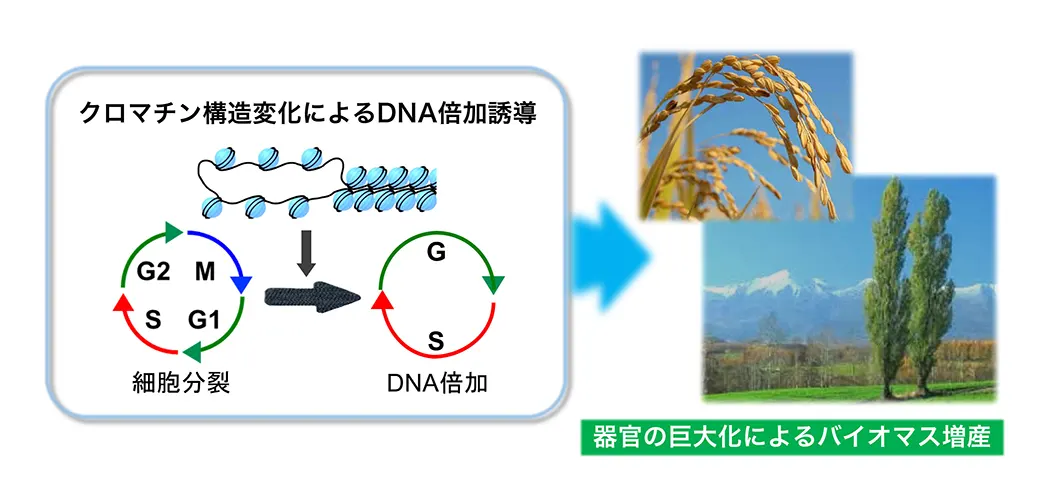
(図3) DNA倍加の誘導機構の理解とその応用
クロマチン構造変化によるDNA倍加の誘導機構を理解することにより、食料・バイオマスの増産につながるDNA倍加の誘発技術を開発し、カーボンニュートラルの実現に貢献する。
主な発表論文・著作
- Takahashi N. et al., J. Exp. Bot., 75, 1364-1375, 2024
- Takatsuka H. et al., J. Exp. Bot., 74, 3579-3594, 2023
- Takahashi N. et al., Sci. Adv., 7, eabg0993, 2021
- Shimotohno A. et al., Annu. Rev. Plant Biol., 72, 273-296, 2021
- Umeda M. et al., Plant J., 106, 326-335, 2021
- Watanabe S. et al., Proc. Natl. Acad. Sci. USA, 117, 31500-31509, 2020
- Umeda M. et al., Curr. Opin. Plant Biol., 51, 1-6, 2019
- Takahashi N. et al., eLife, 8, e43944, 2019
- Takatsuka H. et al., Plant Physiol., 178, 1130-1141, 2018
- Ogita N. et al., Plant J., 94, 439-453, 2018
- Chen P. et al., Nature Commun., 8, 635, 2017
- Kobayashi K. et al., EMBO J., 34, 1992-2007, 2015
- Yin K. et al., Plant J., 80, 541-552, 2014
- Takahashi N. et al., Curr. Biol., 23, 1812-1817, 2013
- Yoshiyama K.O. et al., EMBO Rep., 14, 817-822, 2013
(こちらのリンクはすべて外部サイトへ遷移します![]() )
)
 奈良先端科学技術大学院大学
奈良先端科学技術大学院大学


