分子免疫制御 (河合研究室)
-
研究室ホームページ
- https://bsw3.naist.jp/kawai/
-
全学オンラインセミナー
2022年度に開催されたBio Discovery Session(全学オンラインセミナー)のアーカイブ動画の一覧です。 - Bio Discovery Session
-
Webメディア
NAIST Edge BIOは、奈良先端科学技術大学院大学 バイオサイエンス領域 の各研究室で取り組んでいる「最先端」の研究プロジェクトや研究成果について、研究者だけではなく受験生や一般の方にも分かりやすく紹介するためのWebメディアです。 - NAIST Edge BIO 第22回
研究・教育の概要
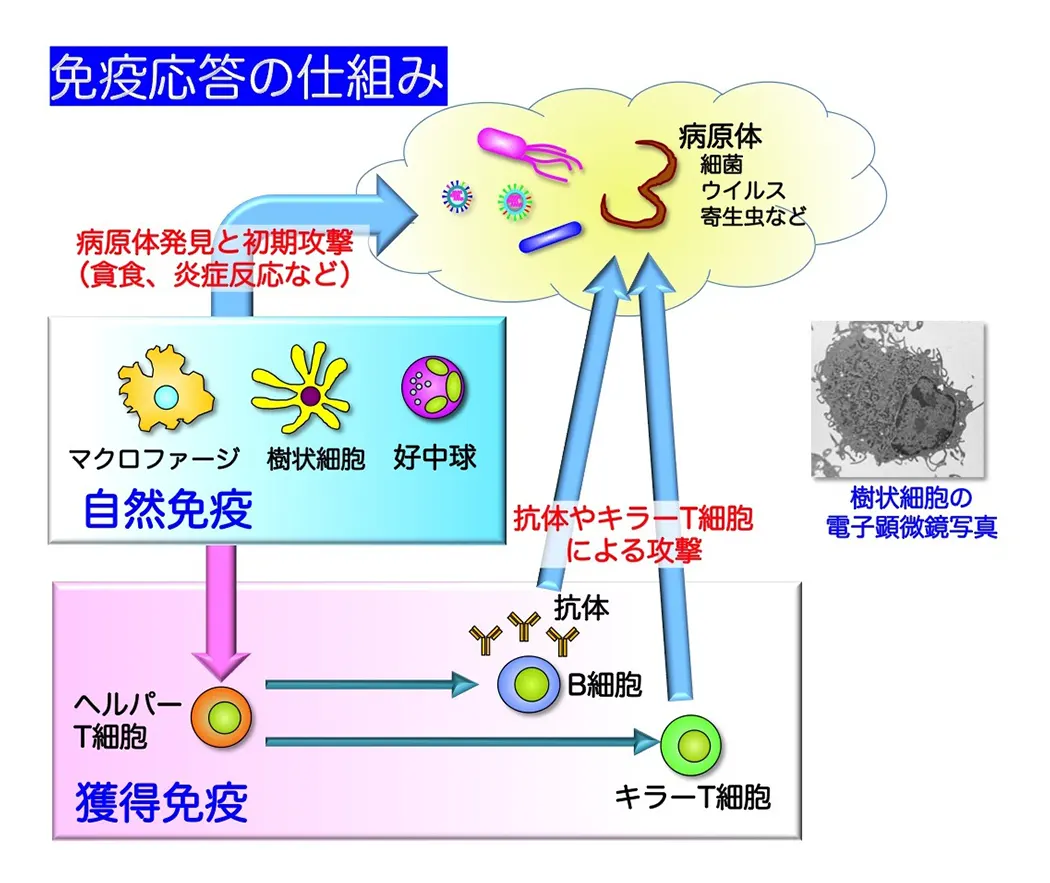
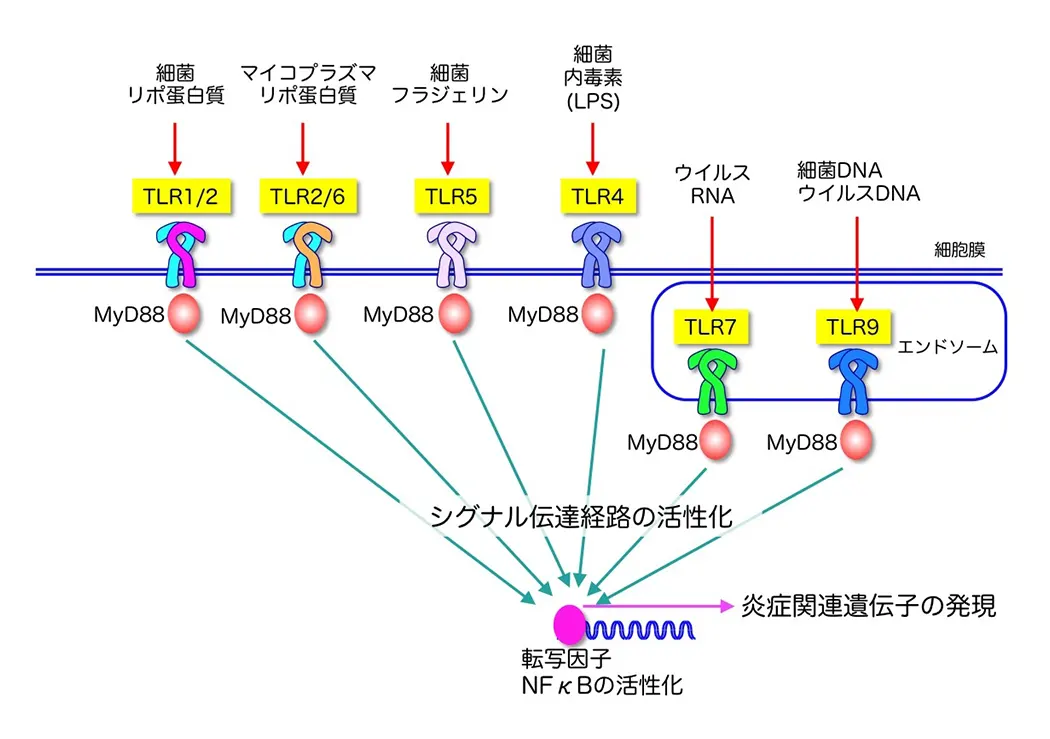
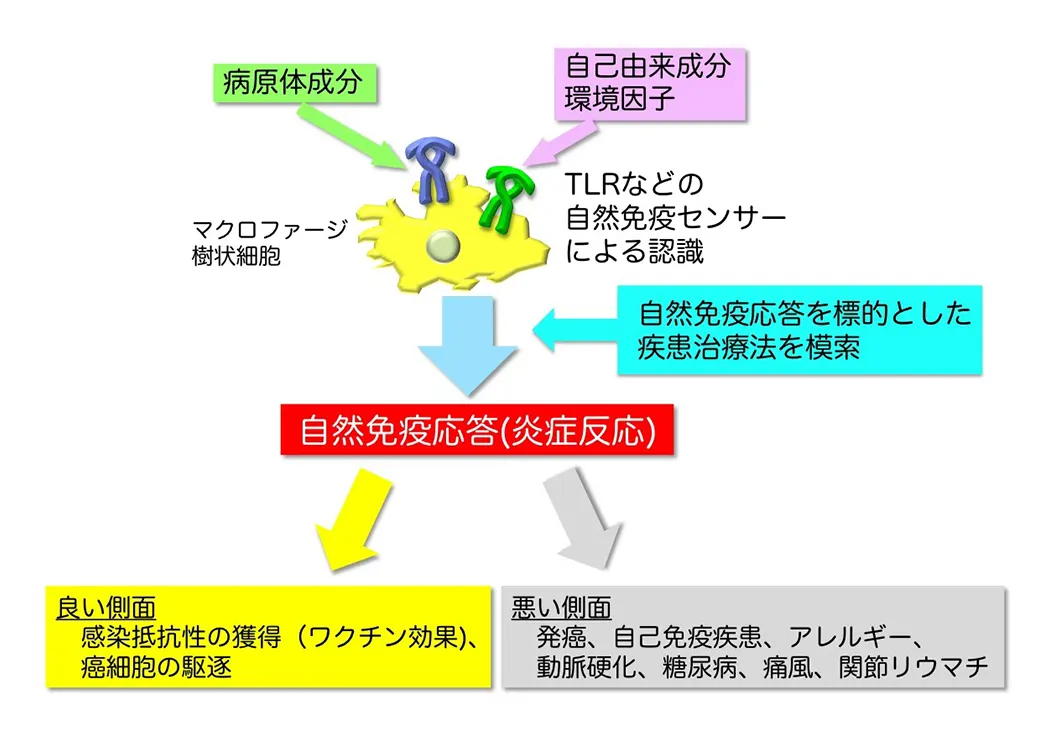
自然免疫はウイルスや細菌といった病原体の感染初期に発動する生体防御システムであり、マクロファージや樹状細胞が中心的な役割を果たしています。これら自然免疫担当細胞は病原体の侵入を察知すると、炎症性サイトカインやI型インターフェロンなどの産生を誘導し、炎症や抗ウイルス反応の惹起、感染局所への免疫細胞の動員、貪食や殺菌等を行います。さらに、自然免疫は、T細胞応答や抗原特異的抗体産生といった獲得免疫の誘導にも必要な応答です(図1)。自然免疫による病原体認識機構は長らく不明でしたが、1996年のショウジョウバエにおけるTollと呼ばれる膜型分子の発見と1998年のヒトにおけるToll様受容体(Toll-like receptor; TLR)ファミリーの発見(いずれも2011年ノーベル賞)を機に、急速に進みました。TLRはヒトで10種類(TLR1-10)、マウスで12種類(TLR1-9, 11-13)存在しており、それぞれが異なる病原体成分(例:細菌のリポ多糖、リポ蛋白質、フラジェリン蛋白質やウイルスのRNAやDNAなど)を認識する受容体として機能しています(図2)。近年では、TLR以外にも、細胞質内でウイルス感染を認識するRIG-I-like receptors (RLRs)ファミリーといった病原体認識分子も同定されています(図3)。重要なことに、自然免疫は病原体のみならず自己成分や環境因子にも反応し炎症を誘導することや、自然免疫系の破綻が自己免疫疾患やアレルギー、炎症性疾患に繋がることが最近の研究から示唆されています(図4)。私達は、自然免疫の全貌を明らかにすることに加え、自然免疫が関与する疾患の制御法の確立や効率的に獲得免疫誘導なワクチンの開発を目指しています。
主な研究テーマ
自然免疫受容体を介したシグナル伝達経路の解析
TLRやRLRを介した自然免疫応答を制御する分子の同定や分子間相互作用などの解析を通して、病原体の侵入から排除に至る流れの理解を目指しています。
新たな自然免疫認識機構や炎症誘導機構の解析
自然免疫は病原体のみならず傷害を受けて死滅した細胞の成分(DNA、RNA、タンパク質、脂質など)に対しても応答し、炎症性疾患や自己免疫疾患を誘導することが分かってきました。しかしながら、これら自己成分がどういった機構(分解、切断、修飾、構造変化、局在変化など)で自然免疫受容体のアゴニストとして質的あるいは量的に変化するのかその破綻機構については不明です)。私たちは、こうした自己成分認識や炎症誘導メカニズムの理解を目指しています。また、自然免疫はアスベストや花粉といった環境因子に対しても反応します。こうした環境因子に対する認識機構を明らかにすることを目指しています。
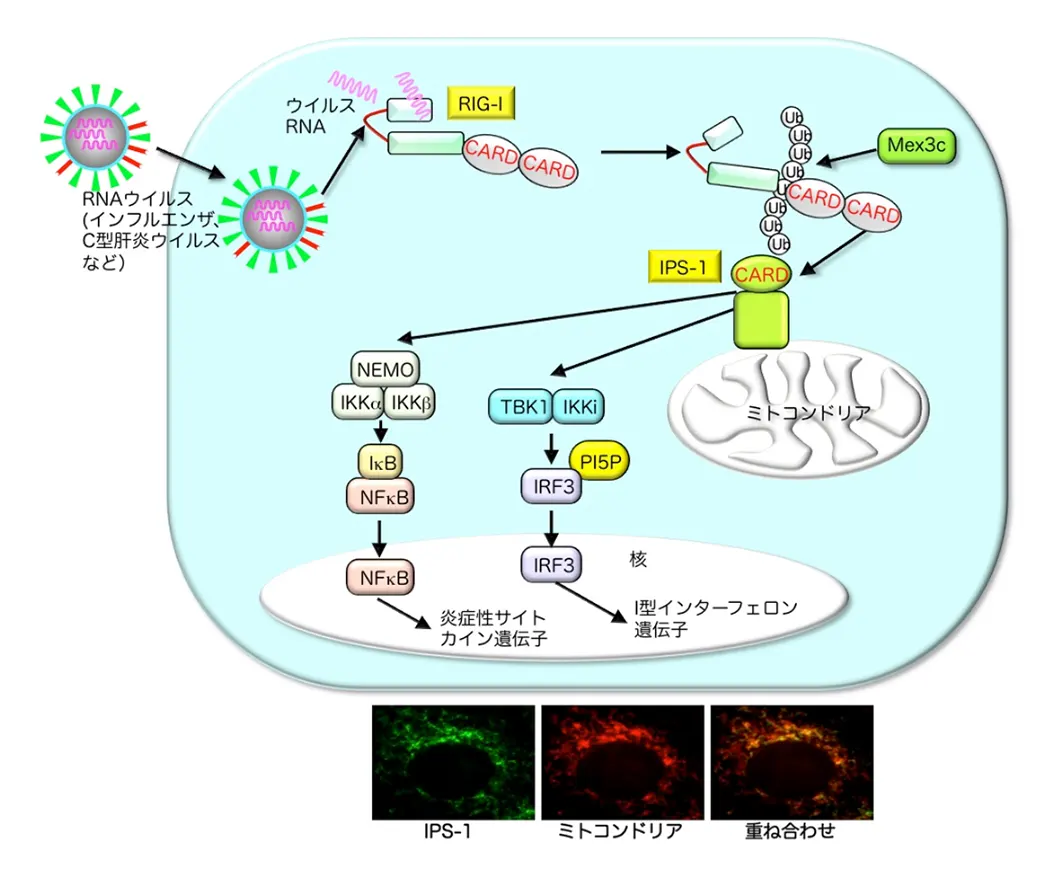
(図3) RLRによるウイルス認識。RLRファミリーの1つRIG-Iは細胞内に侵入してきたウイルス由来のRNAを認識する。RIG-Iはミトコンドリアに局在するアダプター分子IPS-1と結合し、下流シグナル伝達経路を活性化する。
新たな免疫制御法の確立
自然免疫受容体下流シグナル伝達経路の活性化制御可能な核酸、蛋白質、脂質などを用いた新たな免疫制御法の確立を目指しています。最近、細胞内脂質の1つイノシトール5リン酸(PI5P)がRLRのシグナル伝達経路に作用することでウイルスに対する自然免疫応答を制御していることを見いだしました(図3)。合成イノシトール5リン酸をマウスに投与すると抗原特異的な抗体量が上昇することから、ウイルスに対する新たな免疫賦活化剤(ワクチンアジュバント)しての利用が期待されています。
主な発表論文・著作
- Kano N. et al., Int Immunol, 36, 471-481, 2024
- Kawai T. et al., Immunity, 57, 649-673, 2024
- Kawasaki T. et al., Cell Rep, 41, 111828, 2022
- Lian BSX. et al., iScience, 25:104118, 2022
- Hasan MZ. et al., Sci Rep, 11, 16814, 2021
- Sok SPM. et al., Int Immunol, 33, 373-386, 2021
- Zainol MIB . et al., Sci Rep. 9, 20406, 2019
- Putri DDDP et al., J Biol Chem., 294, 8412, 2019
- Sueyoshi T. et al., J Immunol., 200, 3814-3824, 2018
- Murase M. et al., J Immunol., 200, 2798-2808, 2018
- Kawasaki T. et al., EMBO J, 36, 1707-1718, 2017
- Kitai Y. et al., J Immunol, 198, 1649-1659, 2017
- Kawasaki T et al., Cell Host Microbe, 14, 148-155, 2013
(こちらのリンクはすべて外部サイトへ遷移します![]() )
)
 奈良先端科学技術大学院大学
奈良先端科学技術大学院大学