2024.03.01
1'-Acetoxychavicol acetateによるミトコンドリア障害およびNLRP3インフラマソームの抑制
分子免疫制御研究室・助教・織 大祐
- 要旨
- NLRP3インフラマソームと呼ばれる細胞内のタンパク質の複合体の形成(活性化)は、炎症性サイトカインの一つであるインターロイキン (interleukin: IL)-1βの産生において重要な役割を果たし、動脈硬化や痛風、2型糖尿病、アルツハイマー病、炎症性腸疾患の病態とも密接に関連しています。さらに近年、NLRP3インフラマソームはミトコンドリア障害に伴って活性化することが明らかになってきました。私たちは、食材や医薬品として用いられているガランガルに含まれる成分の一つである1'-Acetoxychavicol acetate (ACA) に着目し、ACAがミトコンドリア障害を抑制することでNLRP3インフラマソームの活性化を抑制するとともに、痛風や大腸炎などの病態を改善することを見出しました。
- 主要関連論文
- Sophia P. M. Sok*, Daisuke Ori*,†, Ayana Wada, Haruna Okude, Takumi Kawasaki, Masatoshi Momota, Noor Hasima Nagoor† and Taro Kawai†, 1'-acetoxychavicol acetate inhibits NLRP3-dependent inflammasome activation via mitochondrial ROS suppression., International Immunology, 33(7):373-386, 2021 Jun 18,
doi: 10.1093/intimm/dxab016 (*: equal contribution) (†: corresponding author)
1.はじめに
本研究で用いた1'-acetoxychavicol acetate (ACA) は、ショウガ科の植物の地下茎 (図1) に含まれる成分として発見された小分子化合物です。このACAを含むショウガ科の植物として有名なのがガランガルで、トムヤムクンやトムカーガイといった様々なアジア料理に、香辛料として用いられてきました。一方で、日本で常用されているショウガには含まれていません。また、ガランガルは古くから伝統医薬品としても用いられており、消化器疾患やアレルギーなどに対して効果があるとされています1。
2.ACAによるNLRP3インフラマソームの抑制
これまでの研究から、ACAが、抗がん作用や抗肥満効果、認知機能改善効果を示す可能性が報告されていました2,3,4。これらの疾患はいずれも免疫機能と密接に関連していることから、私たちの研究グループは自然免疫の観点に基づき、多彩な効果を発揮するACAが、どのようなメカニズムで効果を示すのかを解明することにより、ACAの将来的な疾患予防薬あるいは治療薬としての利用可能性を探ることにしました。
まず私たちは、ガランガルやACAが効果を示すとされる肥満や認知症、アレルギー、喘息などの疾患では、その病態形成にインターロイキン (interleukin: IL)-1βと呼ばれる炎症性サイトカインが共通して関与していることに注目しました。さらに、その産生において重要な働きをするNLRP3インフラマソームに着目しました。NLRP3は、自然免疫応答の惹起に必須のタンパク質である自然免疫受容体の一つで、活性化したNLRP3を起点に形成される細胞内タンパク質複合体はNLRP3インフラマソームと呼ばれ、炎症応答の鍵を握っています5。さらに、NLRP3インフラマソームは様々な疾患の病態とも密接に関連していることが明らかとなっており、異常な活性化はIL-1βなどの炎症性サイトカインの過剰放出を引き起こし、組織の損傷や炎症の悪化を促進します5。
NLRP3インフラマソームは、多種多様な物質によって活性化されることが報告されており、例えば、痛風や動脈硬化などの代謝性疾患の原因となる物質(尿酸結晶やコレステロールなど)や、ワクチンアジュバント(補助剤)として使用されているアラム(ミョウバン)、環境由来物質(アスベストなど)、さらには、インフルエンザウイルスやコロナウイルスの持つタンパク質などもNLRP3を活性化することが報告されています5,6。そのため、NLRP3インフラマソームの調節は、これらの疾患の治療や予防において重要な研究対象となっています。
まず、ACAがIL-1β産生に与える効果を評価するため、自然免疫応答の解析に適した免疫細胞であるマクロファージ (食細胞) をマウス骨髄細胞より作製し、その細胞の培養上清にACAを加えて前処置したのち、インフラマソームの形成とそれに続くIL-1βの産生を誘導することができる薬剤を使って細胞を刺激しました。その結果、ACAは、培養液の上澄みに産生されるIL-1βタンパク質の量を顕著に減少させることを発見しました (図2)。
次に私たちは、ACAがどのような仕組みでNLRP3インフラマソームによるIL-1βの産生を抑制しているのかを探りました。NLRP3インフラマソームは多種多様な分子構造が異なる物質により活性化されますが、これらの物質は共通して細胞内の小器官であるミトコンドリアにダメージを与え、その際に酸化されたミトコンドリアDNAが細胞質内に放出される現象に着目7。その酸化型のミトコンドリアDNAをNLRP3インフラマソームが感知して活性化すると考えられていることから、ACAを加えたあとにNLRP3インフラマソームを試薬で刺激して活性化した時の細胞質内の酸化型ミトコンドリアDNA量の変化を測定しました。その結果、ACAは、ミトコンドリアからの酸化型DNAの放出を、刺激前の水準まで抑制していることが判明しました(図2)。こうしたことから、ACAは、ミトコンドリアで生じたダメージを軽減することにより、ミトコンドリアからの酸化型DNAの放出を抑制しており、それがNLRP3インフラマソームの活性化の抑制につながることを突き止めました (図2)。
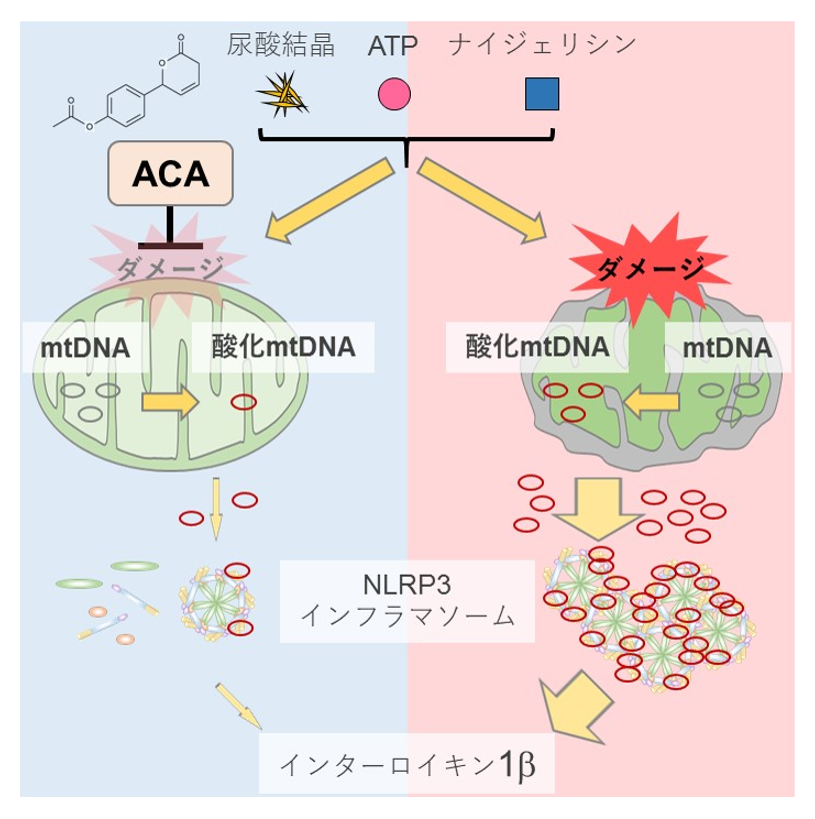
図2.ACAはNLRP3インフラマソームを介したIL-1βの産生を抑制する
ACAは、ミトコンドリア障害を軽減することによって、酸化されたミトコンドリアDNAの細胞質への放出を阻害し、それによってNLRP3インフラマソームの活性化とIL-1βの放出を抑制する。
3.ACAによる大腸炎症状の抑制
次に私たちは、ACAの将来的な予防薬あるいは治療薬としての利用可能性を評価するため、ACAが生体レベルでも効果を示すかどうかを、NLRP3インフラマソームが病態形成に関与するとされているマウスの大腸炎モデルを用いて検証しました。マウスに腸炎を起こす薬剤を飲水投与するとともに、ACAをエサに混ぜて与えたところ、ACAを摂取したマウス群では、下痢や血便、体重減少などの症状が緩和されていました。さらに、大腸上皮細胞でのNLRP3インフラマソームの活性化も抑制され、大腸上皮の組織構造の崩壊も緩和されていました(図3)。これらの結果から、ACAは生体レベルでも、NLRP3インフラマソームの活性化を抑制することが明らかになり、NLRP3インフラマソームが関連する疾患の治療薬候補としての可能性が示唆されました。
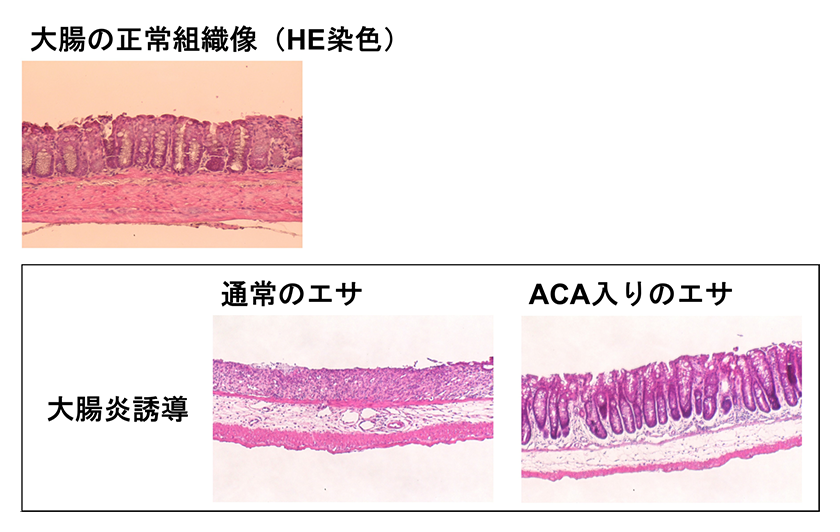
図3.ACAはDSS誘導性大腸炎の病態を緩和する
左上:未処置マウスの大腸上皮組織のHE染色像
左下:大腸炎を誘導し、通常のエサを与えたマウスの大腸上皮組織のHE染色像
右下:大腸炎を誘導し、ACA入りのエサを与えたマウスの大腸上皮組織のHE染色像
4.おわりに
インフラマソーム活性化の結果放出されるIL-1βが病態に関与する疾患は数多く存在します。代表的なものとしては痛風やアルツハイマー型認知症などがありますが、他にもアレルギーや喘息、多発性骨髄腫、最近では、新型コロナウイルス感染症の重症化との関連も明らかになってきました。本研究では、疾患モデルとして大腸炎モデルを用いてACAの効果を検証しましたが、今後は他の疾患モデルも用いてACAの効果を検証することに加え、ACAに類似した物質の同定や機能解析を行うことで、新たな予防薬や治療薬の開発に繋がる可能性があります。
参考文献
織 大祐 NAIST Edge BIO, 0022. (2024)