2023.08.04
生体組織の細胞集団における恒常性維持機構の解明
遺伝子発現制御研究室・助教・秋山 隆太郎
- 要旨
- 生体の恒常性は、組織中に絶えず生じる異常細胞を無効化または排除することによって、組織の均一性を保ち、形態や機能を維持していると考えらます。私たちはそのメカニズムを解き明かすため、様々なモデルを用いて研究を行っています。本稿では私たちの最近の研究から、2つの例を紹介します。まず、マウス胚の体節形成モデルを用い、発生中の体節原基における異常細胞と脊椎骨の奇形との関連を明らかにした研究を紹介します。さらに、上皮細胞培養系とゼブラフィッシュを用い、新規の異常細胞の排出メカニズムを明らかにした研究について解説します。
1.はじめに
私たちのからだの組織は、ある特定の性質をもった細胞からなる細胞集団です。集団内では細胞分裂等の内在的な攪乱や温度変化等の外環境由来の攪乱によって、集団から逸脱した性質を持つ「異常細胞」が一定頻度で出現しており、この出現は個体の寿命が尽きるまで一生涯続くと考えられます。同時に、生体がもつ恒常性はこうした異常細胞の出現を抑える策を講じていることも予想されます。
私たちは、動物胚や成体組織において、細胞の振る舞いや遺伝子発現を詳細に観察することで、周囲の細胞集団から異常細胞がどのように出現し、生体組織はどのようにしてこれを抑制しているのか、さらにはその破綻が疾患・疾病とどのように関連するのかについて理解したいと考えています。本稿では、2つのモデルを例に挙げ、最近我々が見出した現象やその仕組みの一端を紹介します。
2.体節の異常細胞が引き起こす脊椎骨の奇形
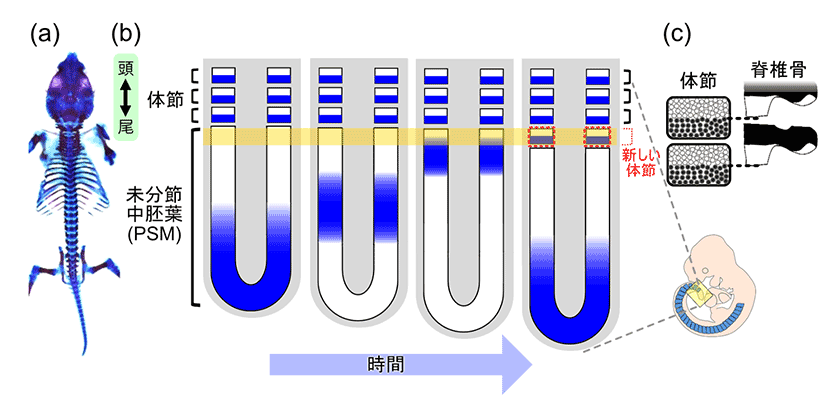
せきつい動物には背骨や肋骨があり、頭尾軸に沿った美しい繰り返し構造をとります(図1a)。この繰り返し構造は、発生中期の体節とよばれる一過性の構造物に由来します。体節は均等な大きさの細胞の集まりであり、胚の頭側から一定時間おきに一対の体節が形成されます(図1b)。後に体節毎に椎骨が形成されるため、体節の繰り返しパターンがそのまま椎骨へと受継がれます(図1c)。
体節原基(未分節中胚葉:PSM)の細胞内では一群の遺伝子が発現振動していますが、近接する細胞集団においては、細胞間のシグナル伝達経路であるNotchシグナルによって遺伝子発現が同調しています1)。このためPSM前端部に遺伝子発現OFFの領域とONの領域が交互に現れ、それぞれが体節の前側と後側のコンパートメント(前後極性)として運命決定された後、合わせて一つの細胞塊として体節が形成されます(図1b黄色部分)。さらに後の椎骨形成時には、1体節内の前後のコンパートメントの境界が分離し、2つの脊椎骨同士の境界となります(図1c)。
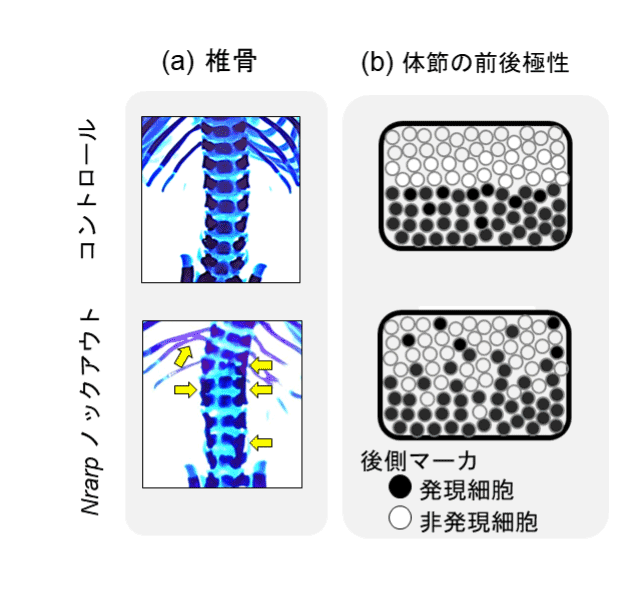
我々は以前の報告2)で、NotchシグナルのフィードバックインヒビターであるNrarpのノックアウトマウスが、散発的な脊椎骨の癒合を示す事を見つけていました(図2a)。そこで、体節内の前後極性マーカ遺伝子の発現を1細胞レベルで調べた結果、コントロールマウスの体節前側では後側マーカを発現する細胞は殆ど見られなかったのに対し、ノックアウトマウスではこうした細胞が高頻度で観察されました(図2b)。このことからNrarpノックアウトマウスの体節では、遺伝子発現状態が周辺細胞とは異なる細胞の割合が増え、体節の前後極性の境界が不明瞭となったことで隣接する脊椎骨が癒合したことが示唆されました(投稿準備中)。したがってNrarp遺伝子は、Notchシグナルを介して体節細胞集団の同調性を制御することで、脊椎骨の等間隔パターン形成に寄与しているという恒常性維持機構が見えてきました。
3.上皮細胞集団による異常細胞の排出
前項で述べた発生過程に加え、成体組織でも細胞集団の恒常性を保つしくみが存在します。我々の体は上皮細胞同士が密に接着した上皮組織に覆われており、体の機械的・化学的バリアとして機能しますが、上皮組織内にはがん原性細胞や死細胞といった異常細胞が一定頻度で出現します。近年の研究から、上皮組織は異常細胞を積極的に排除していることが明らかになってきており、上皮のバリア機能の維持に貢献していると考えられます。例えば哺乳類上皮培養細胞において、RasやSrcなどのがん遺伝子が活性化された異常細胞が正常細胞集団内にモザイク状に存在するとき、正常細胞と異常細胞の相互作用によって異常細胞が上皮細胞層から押し出されます3)。この相互作用は、細胞接着や細胞骨格の関連分子の活性を介して細胞非自律的に制御されており、異常細胞との境界面にフィラミンやアクチンといった細胞骨格因子を集積させて異常細胞を能動的に排除することが示唆されています。このような異常細胞と隣接正常細胞との相互作用については徐々に明らかにされてきた一方で、より広範囲の細胞集団がどのように異常細胞の排除に関与するのかは不明でした。
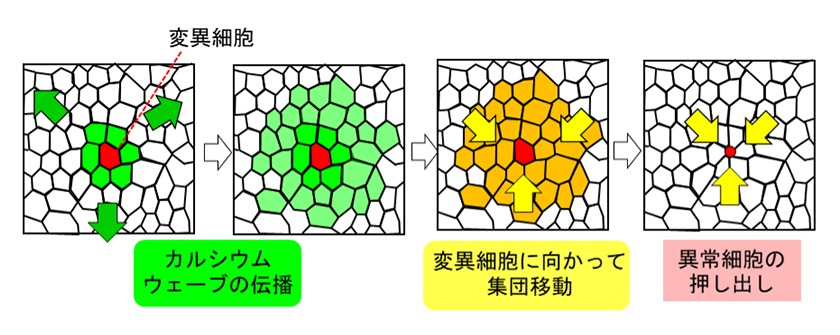
我々は最近の研究で、細胞間相互作用の仲介因子であるカルシウムに着目しました。イヌ腎臓上皮由来細胞(MDCK)やゼブラフィッシュ胚の表皮細胞において、Ras変異細胞または死細胞が排除される際の細胞内Ca2+濃度をライブイメージングすると、押し出される細胞を中心に細胞内Ca2+濃度上昇が波状に伝搬する現象(カルシウム波)が観察されました。このとき、カルシウム波が伝搬した範囲の正常細胞が異常細胞に向かって集団移動し、続いて異常細胞に隣接する正常細胞でアクチンが重合して異常細胞が排出されたことから、カルシウム波が正常細胞集団による細胞の押し出し運動に関与することが示唆されました(図3)。
さらに遺伝子ノックダウンや薬理学的阻害によって、小胞体のCa2+の貯蔵・放出に関与するIP3R、細胞間を物理的に繋ぎ物質輸送も担うギャップ結合分子、機械刺激受容チャネル分子であるTRPC1の阻害がカルシウム波の伝搬を抑制したことから、カルシウム波の生成・伝搬にはこれらの分子を介した細胞間相互作用が関与することもわかりました。このときカルシウム波の伝搬抑制によって、異常細胞周囲のアクチン重合形成と細胞排除が抑制されたことから、カルシウム波が正常細胞の集団移動を引き起こすことで、異常細胞の押し出しを促進するという新しい細胞排除機構の存在が示唆されました4)。
4.おわりに
本稿では、生体組織中に生じる周囲から逸脱した性質の細胞に対し、生体組織がどのように対処しているのかについて、体節組織と上皮組織の例を紹介しました。体節形成過程ではこうした異常細胞を細胞集団と再び同調させ、上皮組織では集団から排除してしまうというやや異なる方法が採られていますが、いずれも細胞集団の不均一性を解消して、組織形態や機能を担保するという戦略は共通しており、生体組織に共通した恒常性維持機構であると考えられます。
また上記の例は、細胞集団の挙動を発生過程や成体の特定期間に絞って観察することで得られた知見です。より長い時間スケールでこれらの現象を考えたとき、一定数の異常細胞が恒常性の網から逃れて蓄積され、やがて個体機能を低下させている可能性があります。今後こうした観点から個体のストレス応答や加齢現象を捉え直すことで、ストレス関連疾患や老化関連疾患の新たなメカニズムの解明に取り組んでいきたいと考えています。
参考文献
秋山 隆太郎 NAIST Edge BIO, 0015. (2023)