2022.08.01
胚発生や細胞分化におけるメチル化DNA結合たんぱく質の役割
機能ゲノム医学研究室・助教・松田永照
- 要旨
- 哺乳類の遺伝情報には、ゲノムDNAの塩基配列情報と、進化に伴って益々重要性が高まっているエピジェネティックとよばれる遺伝情報があります。エピジェネティックスとは、DNA塩基配列の変化を伴わず、遺伝子の発現や細胞の表現型を制御する機構です。その主な一つはDNAのメチル化であり、細胞特異的や時期特異的な遺伝子の発現調節、胚発生や細胞分化など様々な生命現象にとって必要です。DNAメチル化の異常は、正常の胚発生や細胞分化などに異常を引き起こし、ガン化や神経異常など様々な病気の原因となります。本稿前半ではDNAメチルの仕組み、後半では筆者らが同定した新規メチル化DNA結合タンパク質Zbtb38について紹介します。
1.DNAメチル化のライター: DNAメチル化酵素DNMT
哺乳類のDNAメチル化は、シトシンの5番目の炭素(CpG)にDNAメチルトランスフェラーゼ(DNMT)によりメチル基が付加されます。これまでにメチル化されていなかった CpG に、DNMT3a/3bによりメチル基の新規導入を行います。一方で、DNMT1は細胞分裂後のメチル基を維持し、メチル化模様を次世代の細胞に伝達します(文献1)。初期の胚発生(胚盤胞から原腸胚の形成)は、ゲノム上に大規模なCpGメチル化による遺伝情報が書き込まれて次世代に伝わることが知られています。DNMT3a/3b或いはDNMT1の欠損マウスは初期の胎生致死を引き起こしたことから、初期胚の発生にはDNAメチル化酵素が必要であることが示されました。
2.DNAメチル化のリーダー:メチル化DNA結合タンパク質MBP
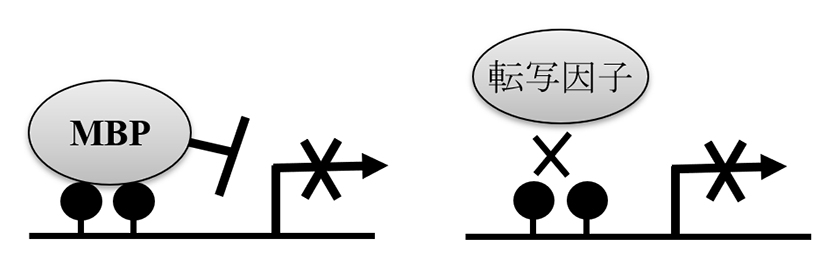
メチル化CpGに結合して転写を制御(主に抑制)するのはメチル化DNA結合タンパク質(MBP)です。遺伝子の発現は通常、プロモーターと呼ばれるDNA領域に転写因子が結合することにより活性化されます。遺伝子プロモーターのCpGがメチル化されると、MBPがメチル化CpGに結合して転写を抑制する場合と、転写因子の結合が阻害される場合があります(図1、文献1-2)。MBPはCpGに結合するドメイン構造の違いにより、MBD型とジンクフィンガー型に分類されます。MBD型には計4種類タンパク質(MeCP2とMBD1/2/4)があります。一方で、ジンクフィンガー型には、BTBドメインを持つタンパク質(Zbtb33、Zbtb4とZbtb38の3種類)と、その他のタンパク質(ZFP57など)があります(文献2)。
どのMBPがメチル化CpGに結合するかは、CpGの特徴(単独か連続か)やCpG周辺の塩基配列の違いによって異なります。DNMTと同様、MBPは遺伝子群発現の安定的な抑制に必要であり、MBP発現の異常はガン化(MBD2の変異は大腸ガン)や神経疾患(MeCP2の変異はレット症候群)など様々な病気の原因だと報告されています。前述の通り、DNMTは初期胚の発生に必須です。しかし、この時期における既知のMBP 遺伝子の必要性が明らかにされていません。
3.メチル化DNA結合タンパク質Zbtb38/CIBZ
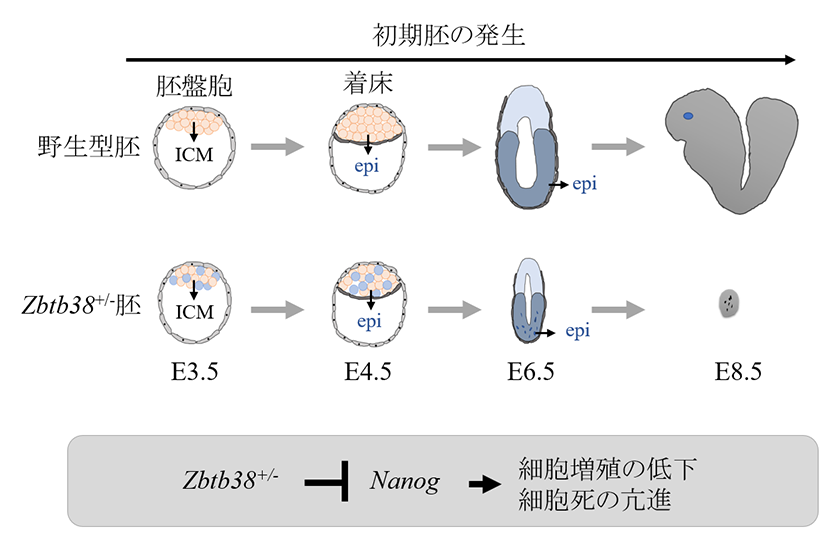
2005年に、筆者らと海外二つのグループがほぼ同時期にそれぞれマウス、ラットやヒトの細胞より転写因子Zbtb38(CIBZともいう)を発見しました。筆者らは、Zbtb38がES細胞などの細胞や各組織に普遍的に発現し、転写抑制と転写活性両方をもつことを見出しました(図2、文献3)。また筆者らは、Zbtb38が、(1)ES細胞のマスター遺伝子Nanog(山中伸弥のグループが発見)の発現調節を介してES細胞の増殖に必要であることや、細胞死に重要であること、(2)骨格筋分化のマスター遺伝子myogeninの転写を制御して幹細胞から骨格筋細胞への分化を抑制すること、(3)心筋分化のマスター遺伝子Mesp1の発現制御を介してES細胞の心筋細胞への分化を抑制することを明らかしました(文献4-7)。さらに筆者らは、Zbtb38の欠損マウスを作製して解析したところ、Zbtb38の欠損が初期胚の胎生致死を引き起こしたことを明らかにしました(図3、文献8)。このことから、正常な胚発生にはDNMTのみならず、MBPも必要であることが明らかとなりました。
海外では、Zbtb38タンパク質の構造解析や結合するDNA配列の解析、酸化ストレス応答におけるZbtb38の重要性、脊髄損傷におけるZbtb38の遺伝子治療の試みが報告されています。さらに世界的なゲノムワイドの解析により、Zbtb38の発現が、ヒトの身長を制御する遺伝子の中で一番重要である(文献9)他、中枢神経変性疾患の発症や重症化、前立腺がんの進行と予後、非アルコール性脂肪肝、加齢性黄斑変性の発症、腎障害などにも重要であることが報告されています。このように、Zbtb38の発現が細胞から個体までの発生や機能維持に重要な役割を果たすことが明らかになっている一方で、個々のメカニズムはほとんど分かっていません。
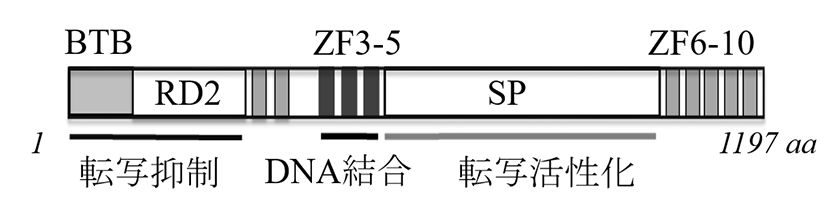
図2.Zbtb38 の一次構造と機能ドメイン
Zbtb38は1197アミノ酸残基(1197 aa)からからなるタンパク質であり、N末端にBTBとRD2という2つ転写抑制ドメイン、DNAに結合するジンクフィンガー(ZF3-5)、中央に転写活性化ドメイン(SP)があります。
4.今後の展望
胚発生、細胞の増殖や分化におけるDNAメチル化酵素の解析が先行していることに対して、MBPの機能解明が遅れています。その一つの例として、DNMTは胎生期の中枢神経系や心臓などの臓器の発生に重要な働きを担うことが知られていますが、MBPについてはどのような役割を果たしているかは十分に解明されていません。
Zbtb38の欠損による初期の胎生致死を引き起こすため、発生の中後期や成体マウスにおけるZbtb38の生理機能がブラックボックスとなっています。胎生致死を回避するため、筆者らは時空間的にZbtb38遺伝子を欠損できる誘導系のマウスを作製しています。今後、中枢神経系などの組織の発生や分化におけるZbtb38の生理的な機能を明らかにし、その制御機構の解明を目指します。これらの解析を通して、Zbtb38の関連する疾患の原因解明と治療法への開発に応用につながることが期待されます。
参考文献
- Smith, Zachary. Nat Rev Genet., (2013)
- Spruijt, Cornelia. Nat Struct Mol Biol., (2014)
- Sasai, N. et al., Genes Cells, (2005)
- Oikawa, Y. et al., JBC, (2008)
- Oikawa, Y. et al., Cell Res, (2011)
- Nishii, T. et al., JBC, (2012)
- Kotoku, T. et al., Sci Rep., (2016)
- Nishio, M. et al. (2022) Cell Prolif 55, e13215.
- Gudbjartsson, D. et al.,Nat Genet., (2008)
松田 永照 NAIST Edge BIO, 0003. (2022)