2024.08.01
遺伝性眼疾患の発症メカニズム解析と治療法の探究
発生医科学研究室・准教授・笹井紀明
- 要旨
- 私たちは、網膜色素変性症と呼ばれる眼疾患について研究を進めています。網膜色素変性症は、重篤な視覚障害を引き起こす疾患で、出生時にはほとんど症状はありませんが、年齢とともに徐々に見えにくくなり、重篤な場合には失明に至ります。私たちは最近、網膜色素変性症のモデルマウスにおけるシングルセル遺伝子発現解析から、発症時に変動する遺伝子を同定しました。現在、これらの遺伝子をターゲットとする新しい治療法の開発を目指しています。
- 主要関連論文
- Naoya Shigesada, Naoya Shikada, Manabu Shirai, Michinori Toriyama, Fumiaki Higashijima, Kazuhiro Kimura, Toru Kondo, Yasumasa Bessho, Takuma Shinozuka, *Noriaki Sasai.
"Combination of blockade of endothelin signalling and compensation of IGF1 expression protects the retina from degeneration". Cellular and Molecular Life Sciences (2024) 81: 51.
DOI: 10.1007/s00018-023-05087-x
1.網膜色素変性症
私たちは外界からの情報のうち80%以上を、目を通して得ていると言われています。「目が見えなくなる」ことは、それ自体が直接、体の生死につながることは多くありませんが、行動が大きく制限され、私たちの生活に大きな影響を及ぼします。我が国には視覚障害を持つ人(障害者手帳を取得した人)が32万人いますが、実際になんらかの形で視力に問題を抱え、日常生活に支障をきたす人々はその5倍以上いると考えられています。
視覚障害をもたらす疾患はいくつか種類がありますが、その1つが網膜色素変性症です。網膜色素変性症は、眼球の中でも網膜と呼ばれる薄い層の部分に存在する光受容細胞という細胞が壊死する病気です(図1)。出生時に症状が出ていることはほとんどありませんが、10-45歳頃から徐々に見えにくくなり、重篤な場合には失明することもあります。我が国には3万人程度、全世界には150万人程度の患者がいると言われています。網膜色素変性症の約半数の症例は、遺伝性(つまり疾患が親から子へと引き継がれていく)であることが知られています。この疾患には現在のところ「絶対効く」と言われる治療法、つまり根治療法はなく、従ってこの疾患は厚生労働省から難病に指定されています。
現在、網膜色素変性症にはさまざまな治療法が考案されています。最近最も期待されているのは、遺伝子治療や再生医療と呼ばれるものです。「遺伝子治療」とは、網膜色素変性症の原因遺伝子を、正常な遺伝子を導入することにより治したり、視覚機能を持つ遺伝子を眼球に導入するものです。また「再生医療」は、ES細胞やiPS細胞から視細胞や網膜色素上皮細胞を分化させ、それを患部に移植するものです。これらの治療は、先進医療または最先端医療として、今後の更なる開発が待たれています。
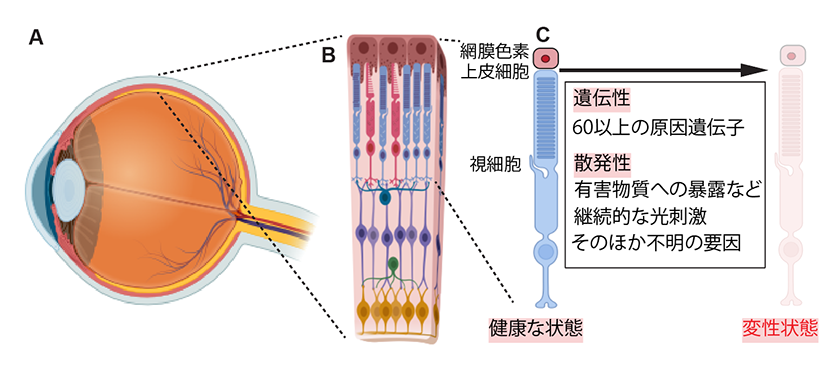
図1.眼球の構造(A)。眼球のうち、網膜は最も奥に位置し(B)、視細胞はその細胞の1つであり、外界からの光刺激を最初に感知する。この視細胞(またはその上部に存在する網膜色素上皮細胞)が、さまざまな要因で変性し始めるのが網膜色素変性症である (C)。
2.網膜色素変性症の発症メカニズム
遺伝子治療や再生医療が眼難病の根治療法である一方、私たちはこれまで、網膜で病変が所持始める時期に着目し、それを治す方法を開発したいと考えました。そのためには、疾患がどのように発症するのか、またその時に視細胞で何が起こっているのかを明らかにする必要があります。この目的で、網膜色素変性症モデルマウス(網膜色素変性症を発症するマウス)を用いて、この発症メカニズムを明らかにするための研究に取り組んできました。
その結果、いくつかのことがわかってきました。まず、眼球(網膜)が継続的に光刺激にさらされることが、発症につながっていることを明らかにしました。次に、発症したときに、網膜の中でも光受容細胞と呼ばれる細胞でエンドセリンという遺伝子が惹起され、これが周囲の細胞(特にグリア細胞や血管内皮細胞)に作用し、グリア細胞の異常な活性化や血管内皮の収縮を引き起こすことがわかりました。一方、エンドセリン阻害剤を投与すると、これらの遺伝子発現が抑制され、結果として細胞死や症状の進行が(一部ですが)抑制できることがわかりました。
また、網膜色素変性症の発症とともに、光受容細胞の細胞内で、グルコース代謝が弱化していることがわかりました。光受容細胞はグルコール代謝の活発な細胞であり、この代謝活性が鈍化することにより、疾患が進行することが明らかになりました。そこで、エンドセリンの阻害と同時に、グルコース代謝を活性化することにより、網膜の状態が一定程度まで改善できることが実験的に証明されました(図2)。これらの結果は、エンドセリンとグルコース代謝の両方を制御することが、眼難病の進行を抑制する働きを持つことを示唆しています。
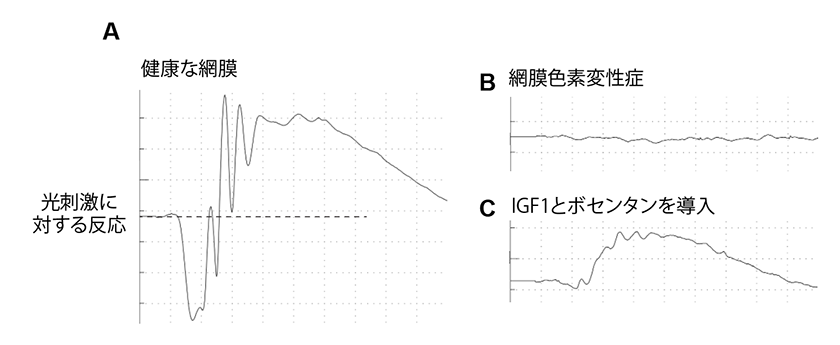
図2.網膜電図による視覚機能の評価。正常なマウス (A) と、網膜色素変性症を発症したマウス (B) における網膜電図。グルコース代謝を改善する遺伝子(IGF1)を、エンドセリン阻害剤であるボセンタンとともに導入すると、視覚機能が部分的に回復した (C)。
3.網膜色素変性症の治療法の開発に向けて
今後、エンドセリンとグルコース代謝をどのように安定的かつ継続的に抑制するかが問題となります。また、これまでの実験は全てが実験動物(マウス)で行われたものであり、実用化には相当のステップが必要と考えます。このようなステップを解決し、今後、より効果的な眼疾患治療法の開発を進めます。
本研究を進めるにあたり,木村和博(山口大学大学院医学研究科・教授)、近藤亨(北海道大学遺伝子病制御研究所・特別教授)には大変お世話になりました。この場をお借りし、厚く御礼申し上げます。また、ともに実験や解析を進めてくれた研究室の同僚のみなさんにも大変感謝しています。
参考文献
笹井 紀明 NAIST Edge BIO, 0026. (2024)

