※2023年度まで
腫瘍細胞生物学 (加藤順也研究室)
教員
 教授
教授
加藤 順也
 特任准教授
特任准教授
加藤 規子
-
全学オンラインセミナー
2022年度に開催されたBio Discovery Session(全学オンラインセミナー)のアーカイブ動画の一覧です。 - Bio Discovery Session
-
Webメディア
NAIST Edge BIOは、奈良先端科学技術大学院大学 バイオサイエンス領域 の各研究室で取り組んでいる「最先端」の研究プロジェクトや研究成果について、研究者だけではなく受験生や一般の方にも分かりやすく紹介するためのWebメディアです。 - NAIST Edge BIO 第20回
研究・教育の概要
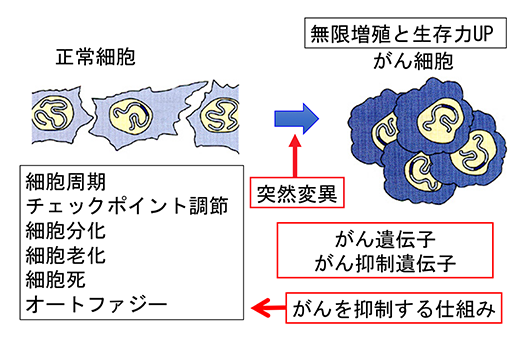
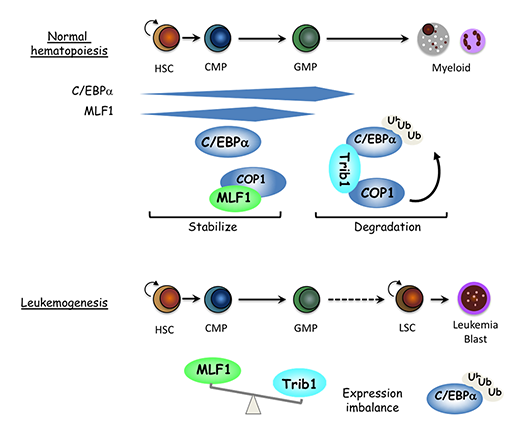
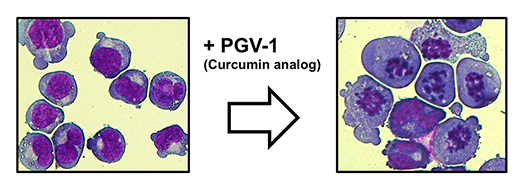
腫瘍細胞の増殖、分化、生存を制御する分子機構についての研究を行っています。研究の分野としては、細胞周期制御、がん代謝、白血病、がん幹細胞、ROS制御が含まれます。これらの分野の研究から腫瘍細胞の特性を明らかにし、その成果は、がんの診断や治療に役立てます。現在は、(1)クルクミン関連分子によるがん抑制、(2)CSN5と細胞がん化、(3)細胞がん(白血病)化と脂質代謝、(4)がん細胞周期とがん代謝のプロジェクトが進行中です。
主な研究テーマ
腫瘍細胞の増殖、分化、生存を制御する分子メカニズム
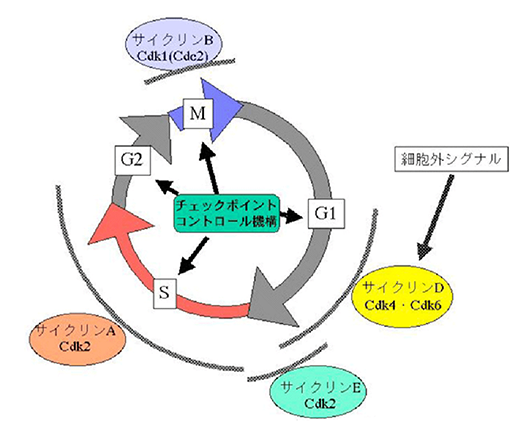
細胞周期制御とチェックポイントコントロール
細胞が増殖するか、あるいは、分化などに向かうかは細胞周期のG1期で決定されます。そのため、癌細胞ではG1期の進行を制御する因子(サイクリンD1/E、Cdk2/4、Cdkインヒビターp27/p21、Rb癌抑制蛋白質など)の変異が多く見られます。放射線や化学物質によりDNAに損傷が起こると、細胞周期を止め修復を行います。このチェックポイントコントロール機構で重要な役割を果たすのが、癌抑制遺伝子産物p53です。私たちはこれらの因子の分子機能を調べています。
細胞老化、細胞分化、アポトーシス
細胞の癌化には、細胞周期の異常以外にも、老化、分化や死のメカニズムが脱制御される必要があります。私たちは、老化誘導、分化誘導や細胞死誘導できる培養系を用いて、癌化と関係する老化阻害、分化阻害やアポトーシスの仕組みについて調べています。
主な発表論文・著作
- Kamitani N, et al., Sci Rep., 12, 22419, 2022
- Ito H, et al., J Clin Invest. 131, 12, 2021
- Lestari B, et al., Sci Rep., 9, 14867, 2019
- Yoshida A, et al., Blood., 122, 1750-1760, 2013
- Yoshida A, et al., Sci Rep., 3, 1054, 2013
- Kato JY and Yoneda-Kato N., Genes to Cells 14, 1209, 2009
- 加藤順也, 加藤規子, 実験医学, 28, 463, 2010
- 加藤順也, 加藤規子, 細胞工学, 28, 1166, 2009
- Yoneda-Kato N. et al., EMBO J., 24, 1739, 2005
- Tomoda K. et al., Nature, 398, 160, 1999
- Kato J-Y. et al., Cell, 79, 487, 1994
(こちらのリンクはすべて外部サイトへ遷移します![]() )
)
 奈良先端科学技術大学院大学
奈良先端科学技術大学院大学