バイオサイエンス研究科動物細胞工学研究室の門倉広博士研究員を含む国際研究チームがタンパク質立体構造形成の新しい制御機構を解明
バイオサイエンス研究科動物細胞工学研究室の門倉広博士研究員を含む国際研究チームは、LptDとよばれるタンパク質が細胞内で折り畳まれる様子を調べ、その過程に、全く新しい、巧妙な仕組みが使われていることを発見しました。この成果は米国科学雑誌Scienceに掲載されましたが、トピックスとして平成24年8月30日付のScience Express電子版にも速報として掲載されました。
掲載論文
Disulfide rearrangement triggered by translocon assembly controls lipopolysaccharide export. Chng SS, Xue M, Garner RA, Kadokura H, Boyd D, Beckwith J, Kahne D. Science 337, 1665-1668 (2012)
門倉広博士研究員のコメント
 Beckwith研究室に滞在中、下記の大腸菌外膜タンパク質の生合成を調べると他のタンパク質と比べてジスルフィド結合の形成に極めて長い時間がかかることが分かりました。したがって、その過程には何か未知の事象が隠されていると予想しました。帰国後、β-バレル型タンパク質の外膜へのアセンブリーを調べているDaniel Kahne教授(ハーバード大学)が、このデータに興味をもち仕事を発展させてくれました。しかし、現象の解明には紆余曲折がありKahneラボの研究員と学生が、膨大な量の実験をしています。ジスルフィド結合の形成は一見すると単純な反応ですが、そこにも巧妙な制御が存在し驚きです。真核生物の分泌タンパク質の生合成過程にも様々な未知の仕組みが存在すると予想され、解明したいと考えています。この国際共同研究が可能になったのは本学のGCOEプログラムと河野憲二教授のおかげです。心からお礼申し上げます。
Beckwith研究室に滞在中、下記の大腸菌外膜タンパク質の生合成を調べると他のタンパク質と比べてジスルフィド結合の形成に極めて長い時間がかかることが分かりました。したがって、その過程には何か未知の事象が隠されていると予想しました。帰国後、β-バレル型タンパク質の外膜へのアセンブリーを調べているDaniel Kahne教授(ハーバード大学)が、このデータに興味をもち仕事を発展させてくれました。しかし、現象の解明には紆余曲折がありKahneラボの研究員と学生が、膨大な量の実験をしています。ジスルフィド結合の形成は一見すると単純な反応ですが、そこにも巧妙な制御が存在し驚きです。真核生物の分泌タンパク質の生合成過程にも様々な未知の仕組みが存在すると予想され、解明したいと考えています。この国際共同研究が可能になったのは本学のGCOEプログラムと河野憲二教授のおかげです。心からお礼申し上げます。
研究の概要
分泌タンパク質や膜タンパク質の多くは、真核生物では、まず、小胞体へと運ばれ、ここで正しい立体構造に折り畳まれます。その際、タンパク質にはジスルフィド結合などが導入されます。正しく折り畳まれたタンパク質のみが、その後、最終的な局在場所へと運ばれていきます。原核生物である大腸菌では、ペリプラズムが真核生物の小胞体に相当します。
大腸菌のLptDは、外膜に局在するβ-バレル型のタンパク質で、分子内に2組のジスルフィド結合をもちます。また、同じく外膜に局在するLptEというタンパク質と2量体を形成します。本研究から、通常のタンパク質とは異なり、このタンパク質の場合には、ペリプラズムへと輸送された直後には、非天然型のジスルフィド結合が導入され活性を持たないことが分かりました。その後、最終的な局在部位(この場合は外膜)へと運ばれ、このタンパク質が、複合体を形成する相方(この場合はLptE)と結合すると、ジスルフィド結合の非天然型から天然型への組換え反応が誘起され、タンパク質が活性化することも判明しました(図1)。これは、タンパク質の折り畳まれ方としては、全く新しい機構です。
それではなぜ、このタンパク質は、局在化と複合体形成に依存して、折り畳まれ、活性化されるのでしょうか?LptD/LptE複合体は大腸菌の外膜でリポ多糖を輸送するための透過孔を構成しています。単純化すると、複合体中では、 LptD部分はβ-バレル構造をとり物質を透過するための孔を形成しますが、相方であるLptE部分は、孔(LptD部分)を制御するための栓として機能します(図1)。よって、この活性化システムは、LptDの無秩序な活性化を抑制し、LptDが機能すべき場所で、適切な制御因子の存在下、活性化し、働くことを可能にする仕組みだととらえることができます。同様の制御は、生物種を問わず、他の複合体でも利用されている可能性があります。
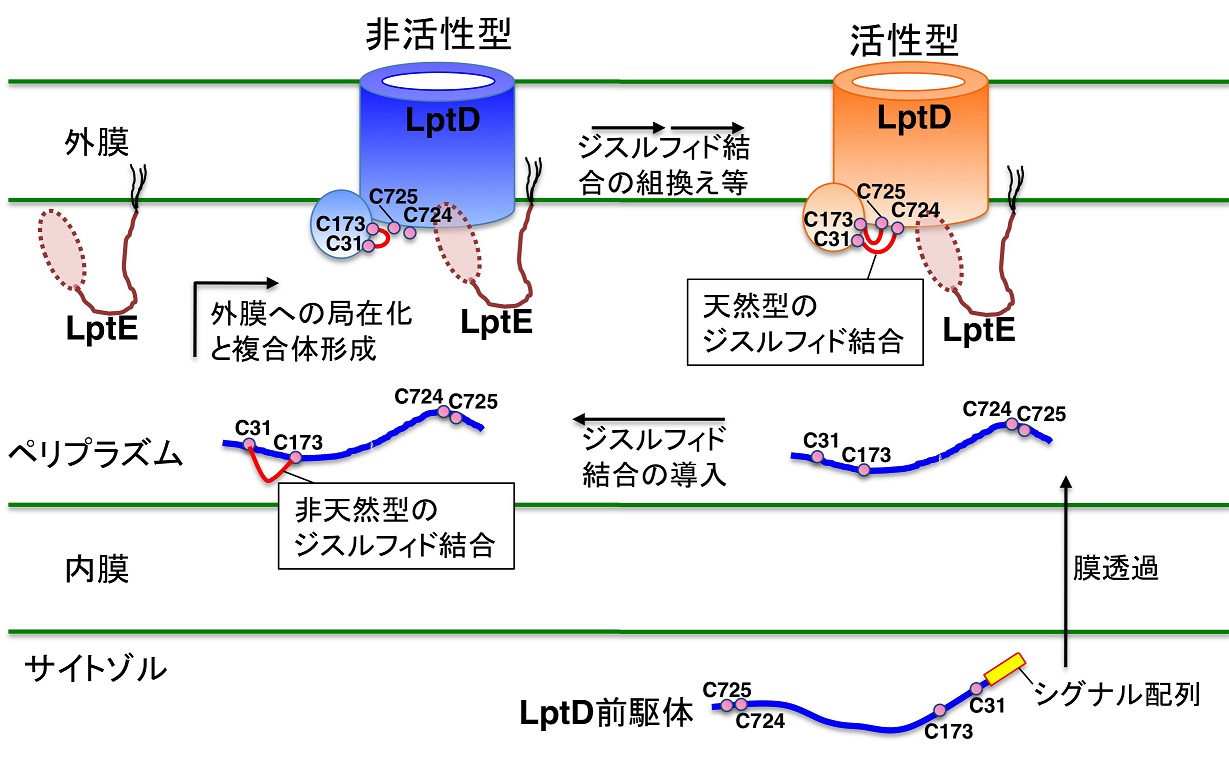
(図1) LptDにおけるジスルフィド結合形成過程
(2012年10月03日掲載)
 奈良先端科学技術大学院大学
奈良先端科学技術大学院大学