細菌の生存に不可欠なリポ多糖の輸送役のタンパク質が、小型タンパク質と形成する複合体の構造と機能を解明
〜小型タンパク質のわずか 10 個未満のアミノ酸の領域で全体構造を安定化する重要な機能を発見〜
細菌の生存に不可欠なリポ多糖の輸送役のタンパク質が、小型タンパク質と形成する複合体の構造と機能を解明
〜小型タンパク質のわずか 10 個未満のアミノ酸の領域で全体構造を安定化する重要な機能を発見〜
発表のポイント
● 大腸菌などの細菌の生存に不可欠なリポ多糖(LPS、注 1)を外膜まで輸送する装置(LptDE)の組み立てを助ける小さなタンパク質 LptM について、その分子鎖の N 末端に位置する 10 個に満たないアミノ酸領域がその機能に重要であることを見出しました。
● 最新のクライオ電子顕微鏡(注 2)を用いた構造解析を通じて、LptM と LptDE がどのように相互作用し、機能するかを分子レベルで解明しました。
● 非常に小さなタンパク質が、より大きなタンパク質装置の組み立てや機能制御に重要な役割を果たす可能性を示しており、基礎生物学の新たな視点を提供します。
【概要】
奈良先端科学技術大学院大学(学長:塩﨑一裕)先端科学技術研究科 バイオサイエンス領域 構造生命科学研究室の塚崎智也教授、宮崎亮次助教、博士前期課程学生 木元麻衣、甲賀栄貴助教らは、細菌のリポ多糖(LPS)を外膜に運ぶ輸送装置(LptDE)の組み立てに関与する小型タンパク質 LptM の構造と機能を明らかにしました。LptM は非常に小さなタンパク質ですが、そのアミノ酸分子鎖の N 末端という位置に連なるわずか 10 残基程度のアミノ酸からなる領域のみで機能を果たせることを発見しました。
さらに、クライオ電子顕微鏡によって LptM と LptDE の複合体構造の解明に成功しました。生物には、LptM のように、より大きなタンパク質装置の組み立てや機能制御に関わる、非常に小さなタンパク質が存在する可能性が示唆されます。
大腸菌などの細菌は外膜と内膜という 2 つの生体膜を持っています。そのうち、外膜は細胞外に直接接しているため、抗生物質などの有害な化学物質に対するバリアとして働き、細菌感染にも密接に関与します。この外膜の機能維持には、リポ多糖(LPS)が不可欠です。LPS は、Lpt 複合体と呼ばれるタンパク質装置によって外膜の外側まで輸送され、LptDE がその輸送の最終ステップで働きます。最近、LptM という非常に小さなタンパク質がLptDE の組み立てに関わることが発見されましたが、具体的にどのように働くのかは分かっていませんでした。
今回の研究では、詳細な変異解析などから、LptM が構造を形成した後の LptDE に結合して働くこと、そして機能に必要なのは N 末端側のわずかなアミノ酸領域であることが分かりました。さらに、クライオ電子顕微鏡によって、LptM とLptDE の複合体構造を決定することで、その構造に基づく解析から LptM がLptDE の組み立てを促進する分子メカニズムを提案しました。
本研究は、細菌の外膜構造形成に関する理解を深めるだけでなく、今後、これまで見逃されてきた小さなタンパク質が他の重要な生命現象にも関わる可能性を示すものです。基礎生物学の発展に寄与するとともに、LptM を模倣した LptDE を標的とする抗菌薬の開発につながる可能性もあります。
本研究成果は、国際科学雑誌「Cell Reports」44 号に 2025 年 7 月 17 日(木)午前 1 時(日本時間)に公開されました(DOI:10.1016/j.celrep.2025.116013)。
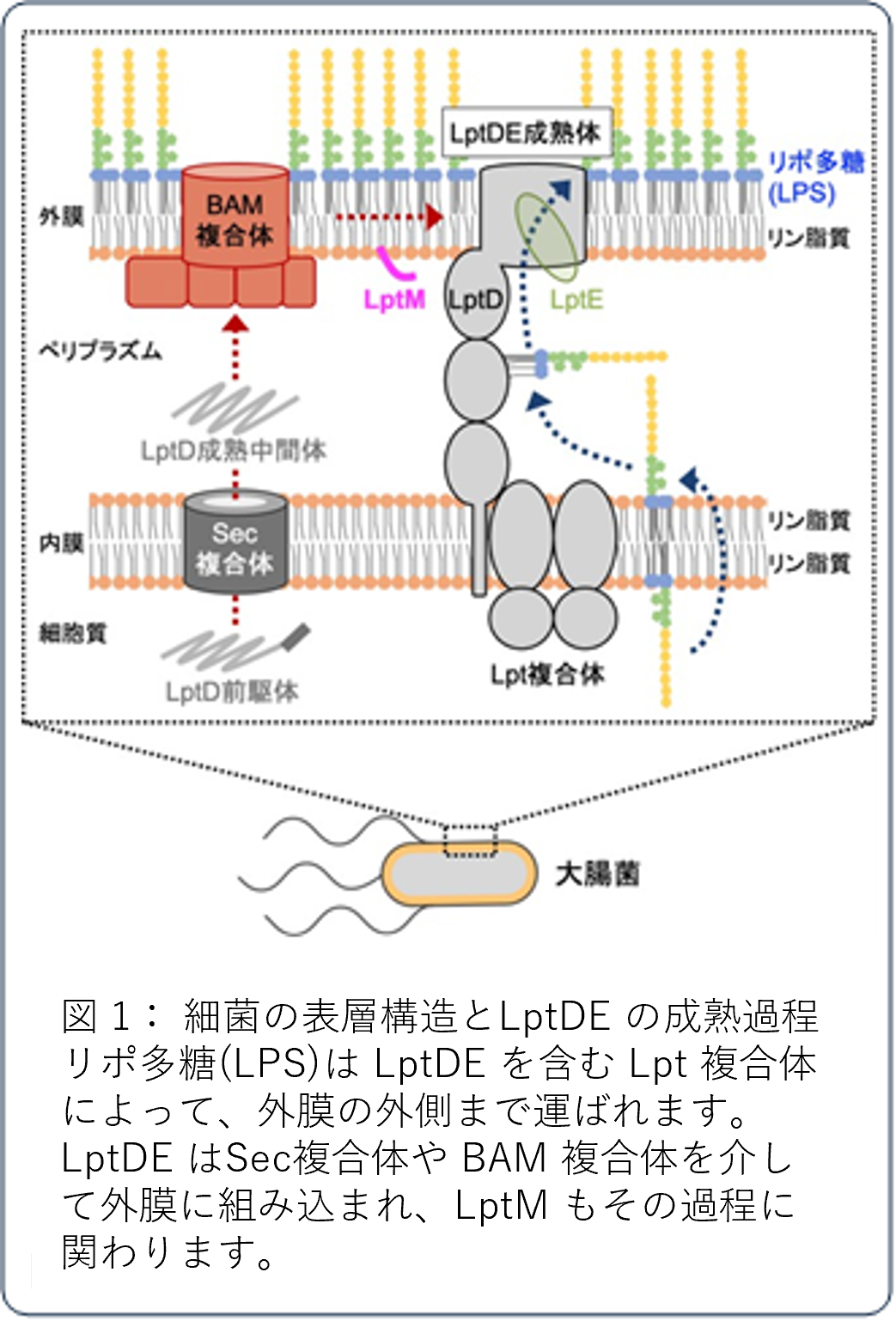
【背景と目的】
大腸菌や緑膿菌などの細菌は、内膜と外膜という 2 つの生体膜を持っています(図 1)。外膜は、細胞外の環境に直接面しているので、抗生物質などの有害な化学物質に対するバリアとして機能し、細菌の感染などにも密接に関与します。この外膜機能には、外膜の外側に敷き詰められたリポ多糖(LPS)が不可欠です。LPS は Lpt複合体と呼ばれるタンパク質装置によって外膜の外側まで運ばれ、LptDE がその最終ステップに働きます。LptDE は細胞質で合成された後、タンパク質膜透過装置である Sec 複合体を介して内膜を通過し、タンパク質膜組み込み装置 BAM複合体により、成熟体構造へ組み立てられつつ、外膜へと組み込まれます(図 1)。最近、新たに LptM という 50 アミノ酸残基程度の小さなタンパク質が LptDE の組み立ての促進に関わることが報告されましたが、その具体的な分子メカニズムは依然として不明のままでした。
本研究では、最新のクライオ電子顕微鏡などを用いた解析により、LptM が如何にして LptDEの組み立てに働くかを解明することを目指しました。
【研究の内容】
本研究では、まず LptM がどのようなタイミングで LptDE に働くのかを調べ、外膜に組み込まれた後の大部分の立体構造を形成したLptDE と結合することを発見しました。さらに、LptM の機能に重要な領域を明らかにするために、LptM のC 末端側を削った変異体を約 40 個作成して、それら LptM 変異体の機能を調べました。その結果、LptM はN 末端のわずか 10 個のアミノ酸に満たない領域だけで機能できることがわかりました。
この非常に短い LptM の領域がどのように LptDE の組み立てを促進しているかを明らかにするために、クライオ電子顕微鏡を用いた構造解析を行いました。LptM が結合した LptDE タンパク質を精製し、その精製タンパク質複合体を脂質と膜骨格タンパク質で作られた「ナノディスク」と呼ばれるナノ粒子に再構成し、クライオ電子顕微鏡でそのタンパク質粒子を観察しました。得られた 2 次元像を解析した結果、3.27 Å 分解能(注 3)で LptDEM 複合体の立体構造を明らかにしました(図 2)。
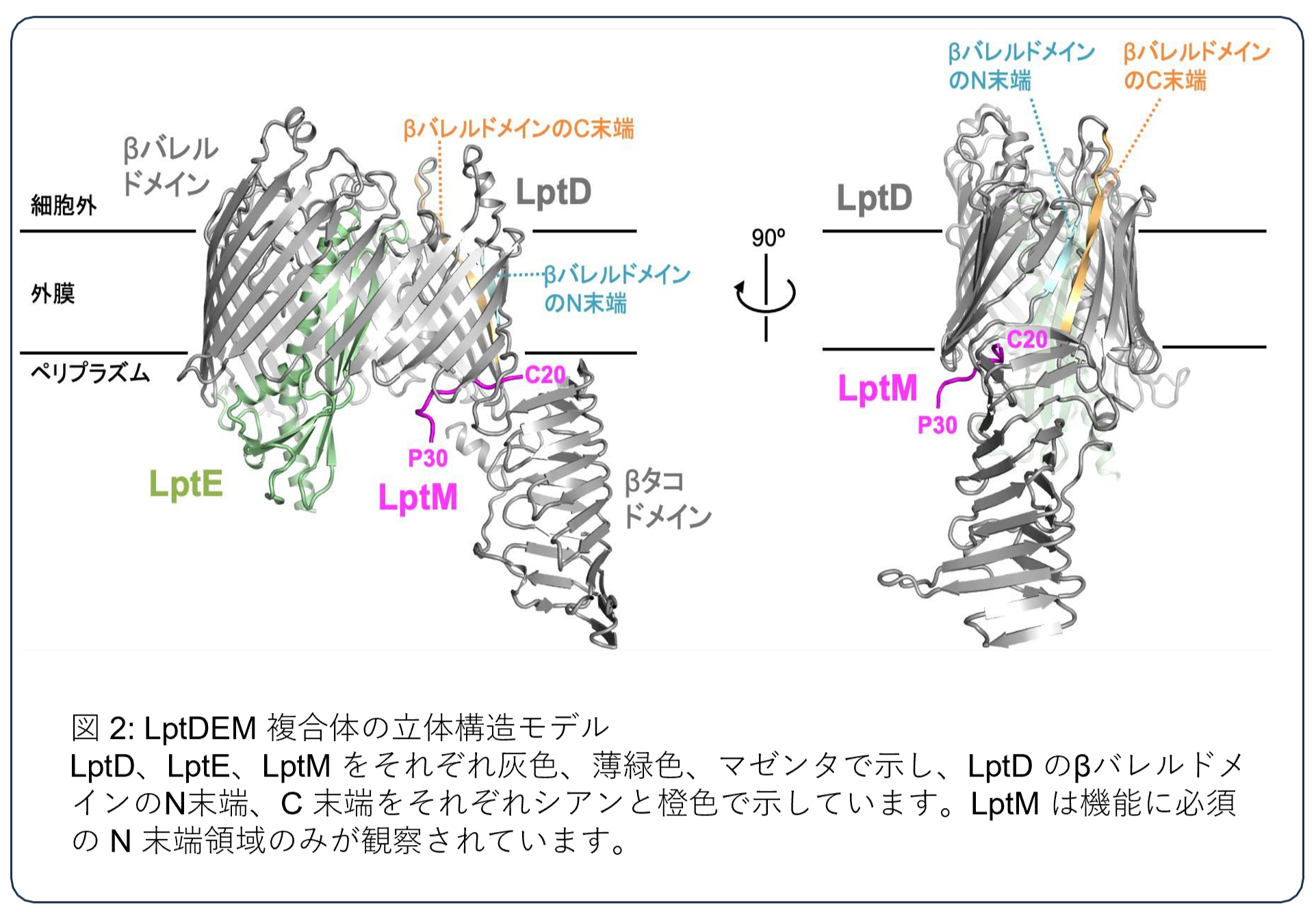
LptDE 複合体中で、LptD の外膜に埋め込まれている領域は、樽のようなβバレルドメイン構造を形成しています。本研究により、決定したLptDEM 複合体構造では、その LptD のβバレルドメインのN末端と C 末端の繋ぎ目の近くに LptM の機能に重要な領域が配置されており(図 2)、LptM のその領域の LptD との相互作用により LptD のβバレルドメイン構造をより安定化することが示唆されました。さらに、立体構造に基づいた架橋解析や機能解析によって、細胞内でも LptM は立体構造と同じようにLptDE と相互作用し、その相互作用が機能に重要であることを示しました。
これらの結果から、LptM は構造をほとんど形成した LptDE のβバレルドメイン構造に直接相互作用して、その構造を安定化することで、LptDE の組み立てを促進するというモデルを提案しました(図3)。
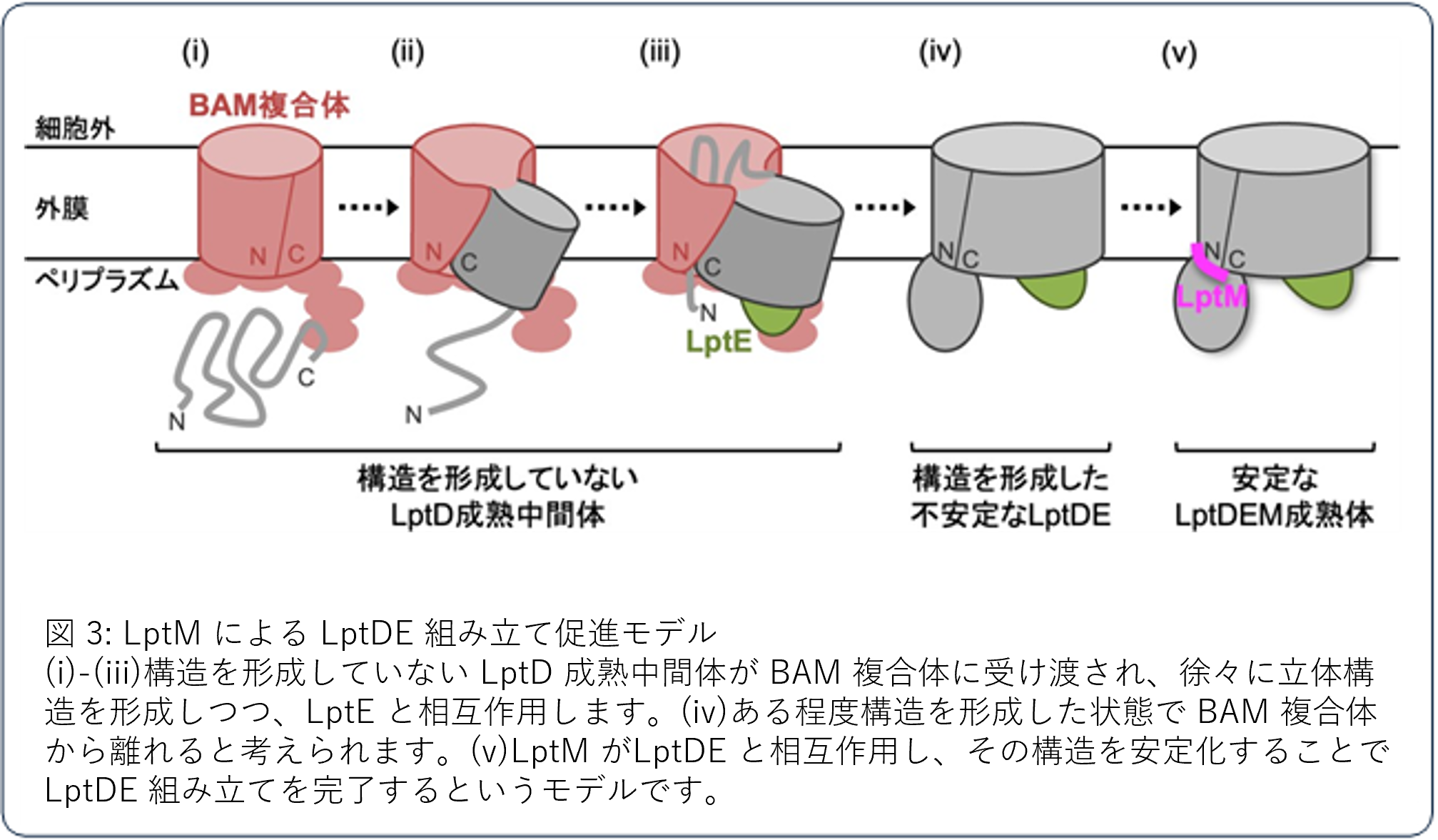
【今後の展開】
本研究では、細菌の外膜構造形成に重要な LptM という小さな因子の N 末端のわずか 10 個に満たないアミノ酸領域が機能することを見出し、さらに、クライオ電子顕微鏡を用いた解析などを通じて、その短い領域が働く分子メカニズムを明らかにしたことが大きな成果です。
本研究は、リポ多糖輸送装置の組み立て機構を明らかにするもので、この機構を特異的に阻害する抗菌薬の開発に資する重要な知見を提供します。加えて、10 アミノ酸に満たない極小のタンパク質が機能することを示したことから、これまで見逃されていたような様々な小さなタンパク質が重要な細胞機能を担う可能性を示します。今後は LptM のように重要な役割を持つ、小さなタンパク質の研究を進めたいと考えています。
【用語解説】
注 1 リポ多糖(LPS):大腸菌などのグラム陰性細菌の外膜の外側にある、長い多糖領域を持つ脂質。外膜機能に重要であり、細菌感染症などにも密接に関与する。
注 2 クライオ電子顕微鏡:タンパク質の構造解析に広く用いられている、試料を極低温に冷却し、電子顕微鏡で観察する手法。X 線結晶構造解析では困難だった、結晶化が難しいタンパク質の構造解析に大きく貢献している。
注 3 分解能:対象物の細部をどの程度まで識別できるかを示す指標。本稿での高い分解能とは、その値(単位は Å)がより低いものを指し、それだけ細部まで識別可能になる。
【掲載論文】
タイトル:Structural basis of lipopolysaccharide translocon assembly mediated by the small lipoprotein LptM(小さなタンパク質 LptM によるリポ多糖輸送装置の組み立て機構の構造基盤)
著者:Ryoji Miyazaki, Mai Kimoto, Hidetaka Kohga, Tomoya Tsukazaki(宮崎 亮次、木元 麻衣、甲賀 栄貴、塚崎 智也)
掲載誌:Cell Reports
DOI:10.1016/j.celrep.2025.116013
【構造生命科学研究室】
研究室紹介ページ:https://bsw3.naist.jp/courses/courses309.html
研究室ホームページ:https://bsw3.naist.jp/tsukazaki/
(2025年07月23日掲載)
 奈良先端科学技術大学院大学
奈良先端科学技術大学院大学