細菌のチオ硫酸イオン取り込みに関わるYeeE/YeeD複合体の詳細構造とチオ硫酸イオン分解酵素YeeDの特殊な反応機構の解明
人は体内で無機硫黄から硫黄含有アミノ酸であるシステインを合成することはできませんが、細菌は無機硫黄を取り込みシステインを合成することができます。これは地球の硫黄循環の一部を担っています。私たちは過去の研究で、細菌のチオ硫酸イオン(S2O32-)を取り込む装置として、YeeEという膜タンパク質を同定し、その構造機能解析を行いました1)。本研究では、YeeEが選択的にチオ硫酸イオンを通すことをSolid Supported Membrane(SSM、固定化膜標本)を用いた解析で示したうえで、YeeEが酵素YeeDと協力して機能することを明らかとし、そのメカニズムを詳細に解析しました。
YeeEとYeeDの共同機構の詳細を解明するために、YeeEとYeeDの複合体の構造をX線結晶構造解析によって2.6Å分解能で決定しました(図1)。このX線回折データの収集はSPring-8 BL32XUで行いました。YeeEとYeeDの結晶構造に見られる相互作用が機能に重要であることは、単一硫黄源をチオ硫酸イオンとした大腸菌生育相補活性を指標とする解析ならびに各種変異体の精製タンパク質を用いたバイオレイヤー干渉(Bio-Layer Interferometry:BLI)法に基づく解析によって確かめました。

4つの保存されたシステインを介してチオ硫酸イオンは細胞内に取り込まれる
この構造をみると、チオ硫酸イオン輸送に重要なYeeEの必須の3つのシステイン残基が連続して並んでおり、さらに細胞質側に「4つ目」のシステイン残基としてYeeDに保存されているシステイン残基が位置していました。細胞外側に存在するチオ硫酸イオンは、YeeEの3つのシステイン残基を介して運ばれて細胞質にあるYeeDのシステイン残基と相互作用することが考えられました。実際、YeeDに保存されたシステイン残基が機能に必須であり、チオ硫酸イオンと反応することで -SH 基が -S-S2O3- と修飾されることを示しました。それだけでなく、-S-S- の状態の分子種も質量分析などで存在が予測されました。また、YeeDはチオ硫酸イオン存在下で、S2- を生成することを蛍光指示薬HSip-1(Dojindo)を用いて示しました。YeeDは、チオ硫酸イオンと反応後SO32-, S2- を放出することで、チオ硫酸イオンを分解すると考えられます。さらに、YeeDがチオ硫酸イオンで修飾された際のYeeE/YeeD複合体の挙動を、分子動力学計算により解析しました。その結果、YeeDの -SH 基が -S-S2O3- となることで、YeeE/YeeD複合体の相互作用が弱まり、YeeDがYeeEから離れていくことが示唆されました(図2)。YeeDは、チオ硫酸で修飾されることで YeeEから乖離し、チオ硫酸イオンを分解し、分解後はまたYeeEと強く相互作用し、次のチオ硫酸イオンを待ち受けて、酵素サイクルを回すと考えられます。
これまで、大腸菌のチオ硫酸取り込むタンパク質として、ATPのエネルギーを使用するABC輸送体が知られていましたが、これとは全く異なった新たなチオ硫酸取り込みの経路の詳細が本研究により解明されました。
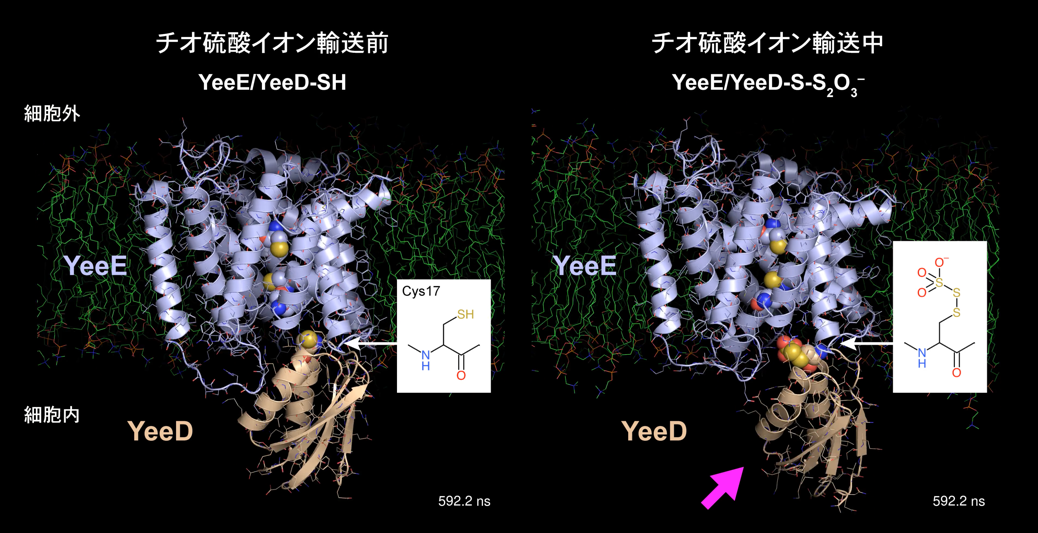
チオ硫酸で修飾されたYeeDは乖離する
参考文献: 1) Tanaka et al., Sci. Adv. 6, eaba7637, 2020
【掲載論文】
論文タイトル:YeeD is an essential partner for YeeE-mediated thiosulfate uptake in bacteria and regulates thiosulfate ion decomposition
Mai Ikei, Ryoji Miyazaki, Keigo Monden, Yusuke Naito, Azusa Takeuchi, Yutaro S. Takahashi, Yoshiki Tanaka, Keina Murata, Takaharu Mori, Muneyoshi Ichikawa, Tomoya Tsukazaki
(伊計 舞、宮崎亮次、門田啓吾、内藤雄介、竹内 梓、髙橋祐太郎、田中良樹、村田景菜、森 貴治、市川宗厳、塚崎智也)
PLoS Biology 22, e3002601 (2024). DOI: 10.1371/journal.pbio.3002601
【構造生命科学研究室】
研究室紹介ページ:https://bsw3.naist.jp/courses/courses309.html
研究室ホームページ:https://bsw3.naist.jp/tsukazaki/
(2024年05月02日掲載)
 奈良先端科学技術大学院大学
奈良先端科学技術大学院大学