感染細胞を排除する細胞性免疫が肺の組織で誘導、記憶される仕組みを解明
肺でのキラーT 細胞の増殖と常在化に肺胞マクロファージが関与
~新型コロナウイルス感染症の重症化抑制など次世代の細胞移植型ワクチンの開発に期待~
感染細胞を排除する細胞性免疫が肺の組織で誘導、記憶される仕組みを解明
肺でのキラーT 細胞の増殖と常在化に肺胞マクロファージが関与
~新型コロナウイルス感染症の重症化抑制など次世代の細胞移植型ワクチンの開発に期待~
【概要】
奈良先端科学技術大学院大学(学長:塩崎 一裕)先端科学技術研究科 バイオサイエンス領域 分子免疫制御研究室の川﨑 拓実(かわさき たくみ)助教、河合 太郎(かわい たろう)教授の研究グループは、本学バイオサイエンス領域 器官発生工学研究室の磯谷 綾子准教授、奈良県立医科大学 伊藤 利洋教授、北畠 正大講師、東京大学医科学研究所 石井 健教授、兵庫医科大学 黒田 悦史教授、理化学研究所 高村 史記チームリーダーらと共同研究を行い、インフルエンザウイルス感染やワクチン投与後に肺組織に形成され、病原体を迎え撃つ細胞性免疫の仕組みを明らかにしました。細胞性免疫は、ウイルス等の病原体に感染した細胞や腫瘍細胞を直接見つけ出し殺傷するキラーT 細胞という免疫細胞が働く機構であり、新型コロナウイルス重症化の抑制や腫瘍細胞の除去に寄与しています。また、最近の研究から、キラーT 細胞の一部は免疫の記憶を持ったまま特定の組織に常在する「レジデントメモリー型」の細胞になり、そこで長期に渡り生存して感染に備えていることが明らかにされています。特に、肺は新型コロナウイルスやインフルエンザウイルス感染の主要な組織であり、キラーT 細胞などの免疫細胞が形成される仕組みの解明は、細胞性免疫を誘導する新たなワクチンの開発に繋がることが期待されます。
今回、研究グループは、肺に存在する肺胞マクロファージという細胞(食細胞)が、抗原を取り込み提示するこ とでキラーT 細胞を増殖させ、さらにインターロイキン 18 と呼ばれるタンパク質(生理活性物質)を分泌することで、レジデントメモリー型キラーT 細胞を維持する役割を果たしていることを見出しました。
さらに、肺胞マクロファージを持たない遺伝子改変マウスでは、抗原投与後にレジデントメモリー型キラーT 細胞の数が減少していました。ところが、興味深いことに、そのマウスに対し、試験管内で抗原を取り込ませた肺胞マクロファージを移植すると、抗原特異的なキラーT 細胞がマウス体内で増え、細胞性免疫が回復することを確認しました。本研究は、肺胞マクロファージの移植という手法により、細胞性免疫や免疫記憶を増強する新たなワクチン開発の基盤となることが期待されます。
この研究成果は、オープンアクセスジャーナル「Cell Reports(セルリポーツ)」 に掲載されました。
【解説】
インフルエンザウイルスや新型コロナウイルスの感染では、一般的には 1 回目の感染に比べ、2 回目の方が免疫応答は素早くなり、増強されます。これは 1 回目の感染により作られた記憶細胞の作用によるものであり、これを利用したワクチンは、感染防御や重症化抑制に貢献しています。感染防御には、ウイルスに対する抗体を獲得することが重要ですが、私達の身体には抗体以外にもキラーT 細胞による細胞性免疫と呼ばれる免疫システムが存在しています。キラーT 細胞はウイルスに感染した細胞に反応し、細胞死を誘導することで感染細胞ごと除去します。また、キラーT 細胞の一部は記憶細胞(メモリー型キラーT 細胞)として体内に長期間留まり、次の感染に備えます。最近の研究から、メモリー型キラーT 細胞の中には全身を循環しているものではなく、特定の組織に留まることで、局所における感染防御や長期記憶に寄与していることが明らかにされています。このタイプのメモリー型キラーT 細胞は、レジデントメモリー型キラーT 細胞と呼ばれています。特に、肺は新型コロナウイルスやインフルエンザ感染の主要な組織であり、キラーT 細胞やレジデントメモリー型キラーT 細胞が重症化抑制に大きく貢献しています。これらのことから、細胞性免疫と長期免疫記憶を十分に付与できるワクチンの開発が求められています。
今回、研究グループは肺の中で細胞性免疫が形成される仕組みを明らかにすることを目的に解析を行いました。その結果、肺に特異的に存在する肺胞マクロファージと呼ばれる細胞が抗原を取り込み、キラーT 細胞に提示することで増殖させ、レジデントメモリー型キラーT 細胞を誘導すると共にウイルスの増殖を抑える役割を果たしていることが明らかとなりました。
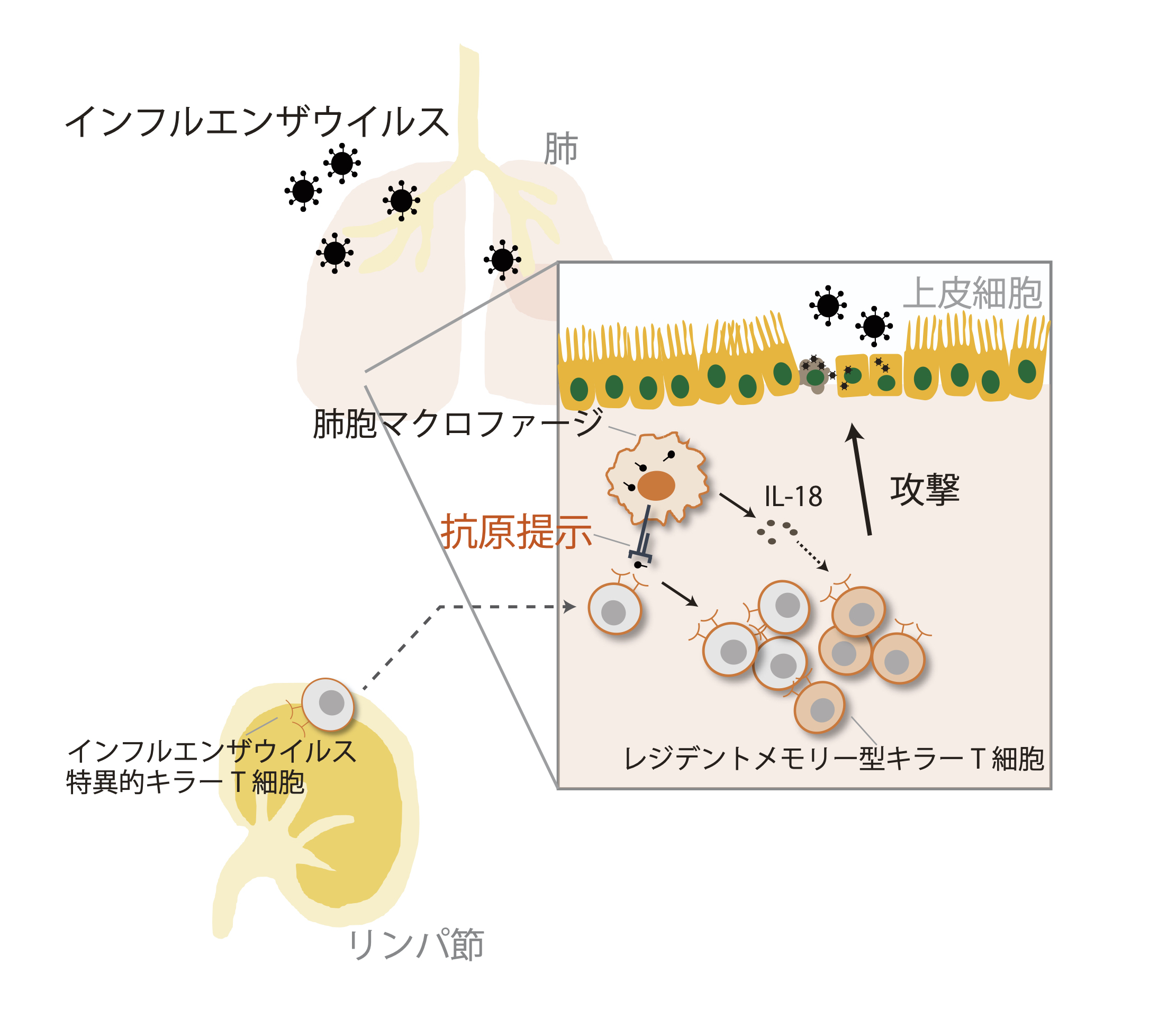
図 1 インフルエンザウイルス感染における免疫応答
インフルエンザウイルス感染やワクチン接種によりリンパ節でつくられたインフルエンザウイルス特異的キラーT 細胞は体内を循環している。次のインフルエンザウイルス感染では、肺胞マクロファージに取り込まれたウイルス断片が抗原として提示され、インフルエンザウイルス特異的キラーT 細胞を活性化し、増殖を促す。増殖したインフルエンザウイルス特異的キラーT 細胞は、感染した上皮細胞の細胞死を誘導することでウイルスの増加を抑える。また、肺胞マクロファージから放出されるインターロイキン 18(IL-18)は増殖したキラーT 細胞をレジデントメモリー型キラーT 細胞に誘導し、長期にわたる生体防御に貢献する。
【研究成果】
研究グループは、1 回目の感染により作られる記憶細胞と同様の細胞を誘導するため、まず、モデル抗原としてよく用いられるオボアルブミン(OVA:卵白のタンパク質)をマウスにワクチンとして皮下に注射しました。OVA の皮下注射により、OVA 特異的なキラーT 細胞がマウスの体の中で誘導されます。次に、OVA 接種 10 日後に鼻腔内より OVA を肺の中へ投与し、さらに 5 日後、肺の中の OVA 特異的なキラーT 細胞を調べると、顕著に増えていることが分かりました。肺の中には様々な免疫細胞が常に呼吸と共に入ってくる病原体を排除するために待ち構えています。どの免疫細胞が捕食しているのかを調べるために、蛍光標識した OVA を肺の中に投与し、捕食した細胞を OVA の蛍光を指標に探索しました。その結果、肺に存在するマクロファージである肺胞マクロファージが OVA を捕食していることが判明しました。そこで、肺胞マクロファージを持たない遺伝子改変マウス(Csf2 欠損マウス)を用いて、OVA の皮下注射と OVA 接種 10 日後に鼻腔内に OVA を肺の中へ投与した結果、肺の中のOVA 特異的なキラーT 細胞が増えていないことが明らかになりました。また、培養した肺胞マクロファージに抗原を取り込ませ、肺胞マクロファージを持たないマウスに移植すると、肺で抗原特異的なキラーT 細胞がマウス体内で増えることがわかりました。これらのことから、肺胞マクロファージが抗原を取り込み、抗原提示を介してキラーT 細胞の増殖を促進していることをつきとめました。
肺の中にいるキラーT 細胞の中には、肺の中で長期間留まり、次の病原体からの感染に備えるレジデントメモリー型キラーT 細胞がいることが知られています。肺胞マクロファージにより誘導されたキラーT 細胞も、一部の細胞がレジデントメモリー型キラーT 細胞として肺の中に留まることがわかりました。次に、肺胞マクロファージのどのような因子がレジデントメモリー型キラーT 細胞の誘導に重要かを調べるため、肺胞マクロファージが分泌するサイトカイン(生理活性物質)を探索すると、インターロイキン 18 の発現が高いことが明らかになりました。そこで、インターロイキン 18 受容体欠損マウスを用いて検討したところ、レジデントメモリー型キラーT 細胞の誘導が抑制されていました。つまり、肺胞マクロファージにより肺の中で増加したキラーT 細胞は、インターロイキン18 の作用により、その一部がレジデントメモリー型キラーT 細胞になることが判明しました。
最後に、実際のウイルス感染における肺胞マクロファージの役割を明らかにするため、野生型及び Csf2 欠損マウスに低量のインフルエンザウイルスを感染させました。感染 30 日後に致死量のインフルエンザウイルスで再感染させました。通常、低量のインフルエンザウイルスを感染させた場合、すでに記憶細胞ができていることからその後に致死量のインフルエンザウイルスに感染させても死ぬことはありません。実際、インフルエンザウイルスが再感染して 5 日後の肺のキラーT 細胞とウイルス量を測定したところ、野生型マウスではインフルエンザ特異的なキラーT 細胞が増加し、肺中のウイルス量が抑制されていました。一方、Csf2 欠損マウスではキラーT 細胞が増えておらず、肺中のウイルス量が増加していました。このことから、肺胞マクロファージの作用によりウイルス特異的なキラーT 細胞が増えることで感染細胞が除去され、ウイルスの増加を抑制していることがわかりました(図 2)。
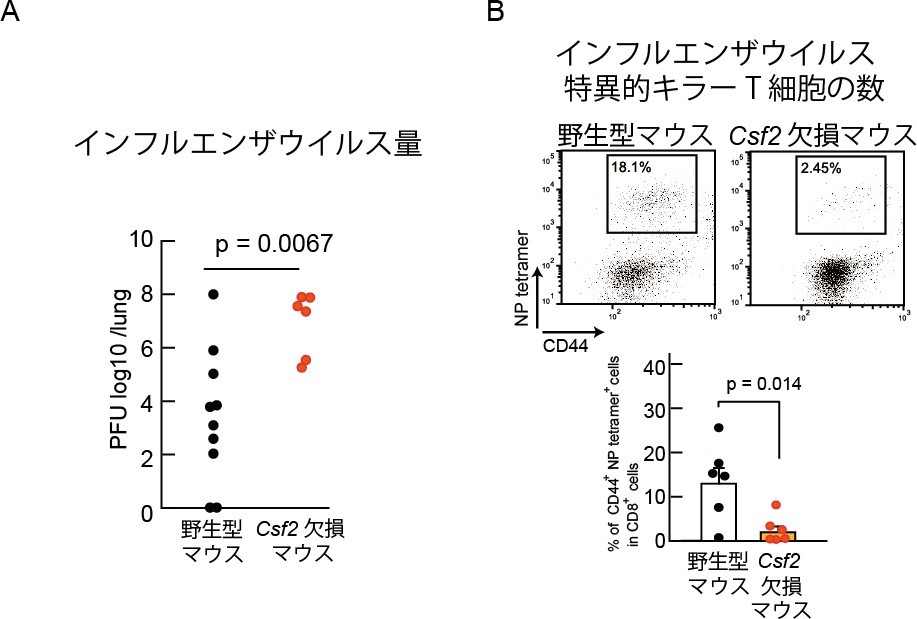
図 2 インフルエンザウイルス感染における肺での免疫応答
野生型及びCsf2 欠損マウスに低量のインフルエンザウイルスを感染させ、30 日後にさらに致死量のインフルエンザウイルスで再感染させた。再感染後 5 日後の肺中のインフルエンザウイルス量(A)とインフルエンザ特異的キラーT 細胞の数(B)を調べた。その結果、野生型マウスに比べ Csf2 欠損マウス(肺胞マクロファージがない)ではインフルエンザウイルス量が多く、インフルエンザウイルス特異的なキラーT 細胞の量が少ないことがわかった。
【今後の展開】
ワクチン接種後や、すでに一度ウイルスが感染した場合、定常な状態でウイルス特異的なキラーT 細胞が準備されています。再感染の際には肺胞マクロファージによりウイルス抗原がキラーT 細胞に提示されることで、キラーT 細胞が素早く増殖し、肺で感染細胞の除去を行うことがわかりました。また、肺胞マクロファージにより増えたウイルス特異的なキラーT 細胞は一部が、インターロイキン 18 によりレジデントメモリー型キラーT 細胞として維持されることが明らかになりました。
肺は新型コロナウイルスやインフルエンザウイルス感染の主要な組織であり、キラーT 細胞やレジデントメモリー型キラーT 細胞が重症化抑制に大きく貢献しています。このことから、キラーT 細胞による細胞性免疫を付与すると共に免疫記憶を形成するワクチンの開発は現在の課題の一つとなっています。
今回、試験管内で抗原と共に培養した肺胞マクロファージをあらかじめ免疫を施したCsf2 欠損マウスに移入すると、抗原特異的なキラーT 細胞やレジデントメモリー型キラーT 細胞が増えることをつきとめました。将来、肺胞マクロファージの移入を用いた「細胞移植型ワクチン」の開発が期待されます(図 3)。
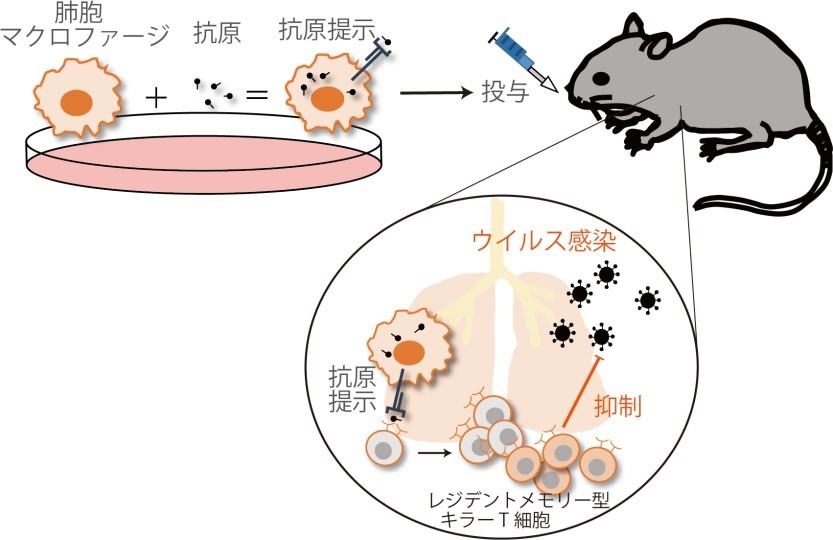
図 3「細胞移植型ワクチン」のモデル
試験管内で培養した肺胞マクロファージにウイルス特異的な抗原を添加することで、抗原提示を誘導する。抗原提示した肺胞マクロファージを移植することで、肺のウイルス特異的なレジデントメモリー型キラーT 細胞を誘導する「細胞移植型ワクチン」の開発が期待される。
【用語解説】
キラーT 細胞:感染した細胞に結合し、細胞死を誘導する物質を放出することで感染細胞を除去する役割を持つ免疫細胞。
細胞性免疫:主にキラーT 細胞を介した生体防御の仕組み。
レジデントメモリー型キラーT 細胞:肺などの特定の組織に長期間留まり、その組織において次の感染に備える記憶細胞。
肺胞マクロファージ:肺胞の中に存在するマクロファージで、肺の中に入ってきた病原体や粒子などを捕食する細胞。
インターロイキン 18:細胞が分泌し、周りの細胞に働きかける生理活性化物質の一つで、主に T 細胞に働きかけ活性化を誘導する。
抗原提示:病原体を捕食した細胞が、病原体を分解し、病原体の一部を抗原として、細胞表面にその一部を提示する仕組み。
【特記事項】
日本学術振興会科学研究費助成事業基盤研究 B,C、戦略的創造研究推進事業 CREST:細胞外微粒子に起因する生命現象の解明とその制御に向けた基盤技術の創出、先進的研究開発戦略センターAMED-SCARDA: 革新的アジュバント・ワクチンキャリアの開発と技術支援ならびにデータベースの構築、武田科学振興財団 特定研究助成より支援を受けて実施されました。
【論文情報】
タイトル:Alveolar macrophages instruct CD8+ T cell expansion by antigen cross-presentation in lung
著 者 名 :Takumi Kawasaki, Moe Ikegawa, Kosuke Yunoki, Hifumi Otani, Daisuke Ori, Ken J Ishii, Etsushi Kuroda,
Shiki Takamura, Masahiro Kitabatake, Toshihiro Ito, Ayako Isotani, and Taro Kawai
雑誌:Cell Reports
Cell Reports 41 (2022) 111828 DOI:10.1016/j.celrep.2022.111828
URL:https://www.cell.com/cell-reports/fulltext/S2211-1247(22)01720-X
【分子免疫制御研究室】
研究室紹介ページ:https://bsw3.naist.jp/courses/courses209.html
研究室ホームページ:https://bsw3.naist.jp/kawai/
(2022年12月14日掲載)
 奈良先端科学技術大学院大学
奈良先端科学技術大学院大学