ペプチド融合タンパク質を用いた微小管「超」構造体の構築に初めて成功
〜分子ロボットなどのナノ材料への応用や繊毛・鞭毛の形成原理の解明に期待〜
ペプチド融合タンパク質を用いた微小管「超」構造体の構築に初めて成功
〜分子ロボットなどのナノ材料への応用や繊毛・鞭毛の形成原理の解明に期待〜
【ポイント】
・チューブ状細胞骨格である微小管*1 に結合するペプチドを融合したタンパク質を開発し、微小管の内部および外部に選択的に結合させることに成功した。
・このタンパク質の結合により、抗がん剤であるタキソール*2 よりも微小管構造が安定化されることを明らかとした。
・微小管が側面で 2 つに連なったダブレット構造や、分岐構造、100 μm 近い長い微小管、アスター型構造など、多様な超構造体の形成に成功した。
・通常の微小管と異なる構造・性質の微小管超構造体からなる新規ナノ材料の開発や、天然に存在する微小管超構造体の形成原理の解明が期待される。
【概要】
鳥取大学学術研究院工学系部門の稲葉央准教授、松浦和則教授らの研究グループは、奈良先端科学技術大学院大学バイオサイエンス領域の市川宗厳助教(当時、現・复旦大学)、塚崎智也教授らの研究グループおよび北海道大学大学院理学研究院の角五彰准教授、佐田和己教授らの研究グループとの共同研究により、独自に開発したペプチド融合タンパク質を用いることで、細胞骨格の一種であるタンパク質ナノチューブ「微小管」からなる多様な超構造体を人工的に構築することに世界で初めて成功しました(図 1)。微小管は一般的には一巻きからなるシングレット型の構造を取りますが、天然では繊毛や鞭毛*3 中に見られるダブレット型構造や枝分かれした分岐構造など、様々な超構造体を形成します。しかし、これらの超構造体を人工的に構築することは困難でした。本研究では、研究グループが以前開発した微小管内部に結合する Tau 由来ペプチド(TP)*4 を四量体蛍光タンパク質 Azami-Green(AG)*5 に連結することで、微小管内部への結合による微小管の極めて高い安定化と、外部への結合によるダブレットや分岐などの超構造体の形成を達成しました。本成果により、微小管からなる分子ロボットなどのナノ材料としての応用や、繊毛・鞭毛の形成原理の解明につながると期待されます。本成果は 2022 年 9 月 8 日(日本時間)に米国科学振興協会発行の学術誌「Science Advances」に掲載されました。
本研究は、日本学術振興会(JSPS)科研費(JP19K15699、JP20K15733、JP22K15075、JP21KK0125、JP20H05972、JP21K04846、JP18H05423、JP21H04434)、科学技術振興機構(JST)ACT-X(JPMJAX2012、研究代表者:稲葉央)、創発的研究支援事業(JPMJFR2034、研究代表者:稲葉央)、さきがけ(JPMJPR20E1、研究代表者:市川宗厳)などによる支援を受けて行われました。
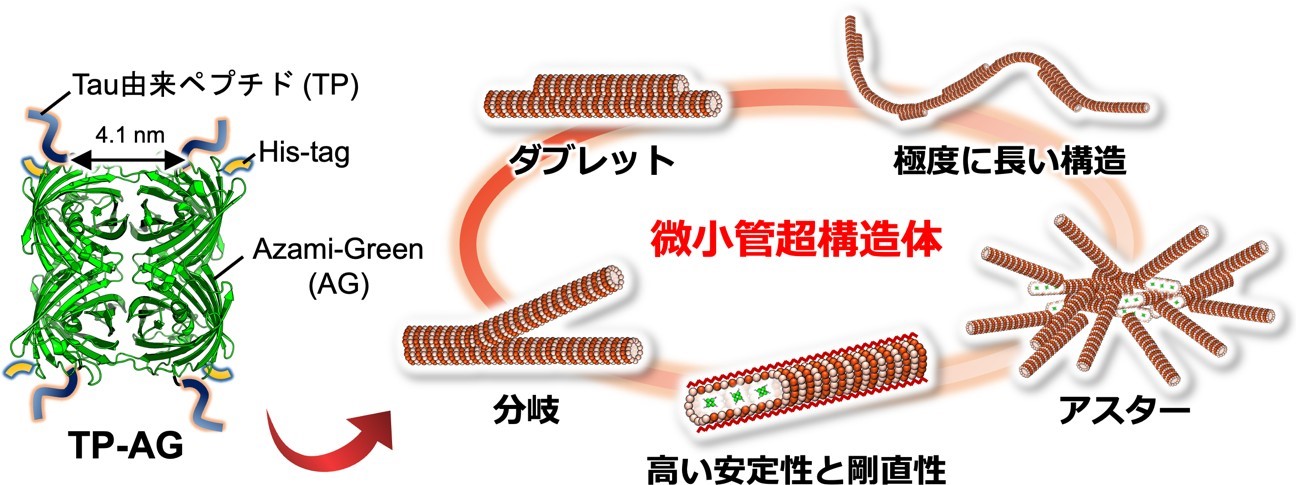
図 1. 本研究の概念図。TP を融合した AG(TP-AG)により多様な微小管超構造体が形成できた。
【研究背景】
細胞骨格の一種である微小管は、チューブリンタンパク質から構成される一般的に内径約 15 nm、長さ数μm〜数十μm のチューブ状集合体です(図 2a)。微小管を利用した分子デバイスや極小のロボットである分子ロボットなどのナノ材料の開発が盛んに行われていますが、それらは全て一巻きのシングレット微小管を用いたものでした。一方天然では、主に繊毛や鞭毛に見られるシングレット微小管(A 小管)の外側にもう一層(B 小管)連結したダブレット微小管や、2 本のシングレット微小管に分かれる分岐構造、微小管形成中心*6 から微小管が伸びるアスター(放射状集合)構造など、多岐にわたる微小管の超構造体が存在し、それぞれの役割を果たしています(図 2b)。これらの微小管超構造体を人工的に構築できれば、新規ナノ材料としての応用や、天然の微小管超構造体構築原理や性質の解明につながると期待できます。しかし、これまで人工的に微小管超構造体を構築した例はほとんどありませんでした。天然では、微小管の内部と外部への様々なタンパク質の結合によってダブレット微小管が安定に形成されていることが示唆されています。そこで本研究グループは、独自に開発した微小管内部に結合するペプチドを四量体タンパク質に融合することで、 微小管の内部と外部への結合を制御し、条件に応じてダブレット、分岐、100μm近い長い微小管、アスターなどの様々な微小管の超構造体形成を誘起することに成功しました。
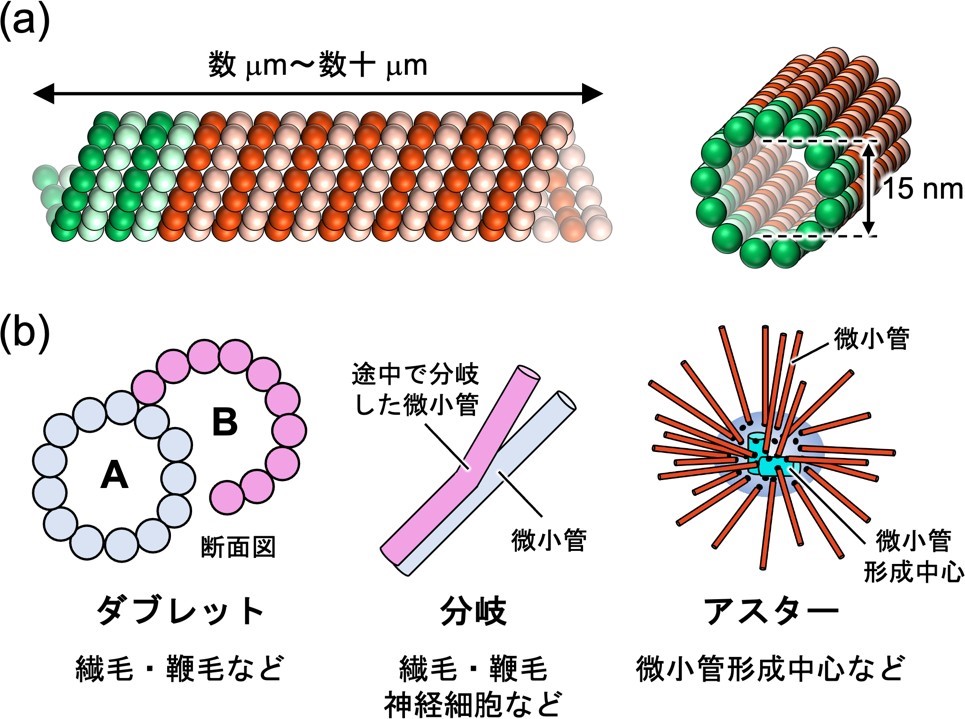
図 2. (a) 一般的なシングレット微小管 (b) 天然に存在する微小管超構造体。ダブレット微小管は完全な A 小管と不完全な B 小管からなる。分岐構造は図のようにダブレット微小管から 2 つのシングレット微小管に分かれるものや、シングレット微小管の側面から別の微小管が成長するものがある。アスターは微小管形成中心から微小管が伸びて形成される。
【研究内容】
微小管内部に相当するチューブリンポケットに結合する Tau 由来ペプチド(TP)を四量体蛍光タンパク質 Azami-Green(AG)の C 末端に連結した TP-AG を作製しました。その N 末端には His-tag*7 を導入してあり、これが微小管外部への結合モチーフとして機能します。チューブリンはグアノシン三リン酸(GTP)と結合することで重合して微小管を形成するため、TP-AG を添加するタイミングを変えることで微小管への結合位置の制御を試みました(図 3)。“Before” method では、まずチューブリンと TP-AG を複合化し、その後 GTP またはその類似体を添加することで微小管を構築しました。“After” method では、微小管を作製した後に TP-AG を複合化しました。蛍光顕微鏡観察により、どちらの方法でも TP-AG が微小管に結合することがわかりました。また、AG に結合する抗体を用いた評価などにより、“Before” method では TP-AG が微小管内部に、“After” method では微小管外部に主に結合していることが明らかとなりました。TP-AG を複合化すると微小管形成が大幅に促進され、安定な微小管が形成されました。この微小管の形成促進・安定化は、微小管を安定化して機能する抗がん剤タキソールを超える効果でした。さらに、TP-AG は微小管構造を補強し、通常の微小管に比べ剛直な構造を形成することが確認されました。
TP-AG 複合化微小管をネガティブ染色電子顕微鏡*8で観察したところ、通常は見られないダブレット型の微小管や分岐構造が確認されました(図 4a)。それらの超構造の量は、特に“After” method で多いことから、微小管外部に TP-AG が結合することで超構造形成が誘起されたと考えられます。クライオ電子顕微鏡*9 解析により、TP-AG によって誘起されたダブレット構造は明確に A 小管と B 小管と思われる構造が確認でき、その直径は繊毛から単離したダブレット微小管とほぼ一致しました(図 4b)。さらに、全反射照明蛍光顕微鏡*10 を用いることで、分岐構造が成長する過程を追跡することに成功しました(図 4c)。これらの結果から、TP-AG が微小管外部に結合することで、露出した TP に新しいチューブリンが結合して集積し、ダブレットや分岐構造の形成が誘起されたと推定されます(図 4d)。これらに加え、TP-AG の量やその複合化法などの条件を変えることで、100 μm 近い極めて長い微小管構造や、運動性を有するアスター構造の形成にも成功しています(図 5)。このように、一種類のペプチド融合タンパク質にも関わらず、条件を変えることで多様な微小管超構造体が形成されることが明らかとなりました。
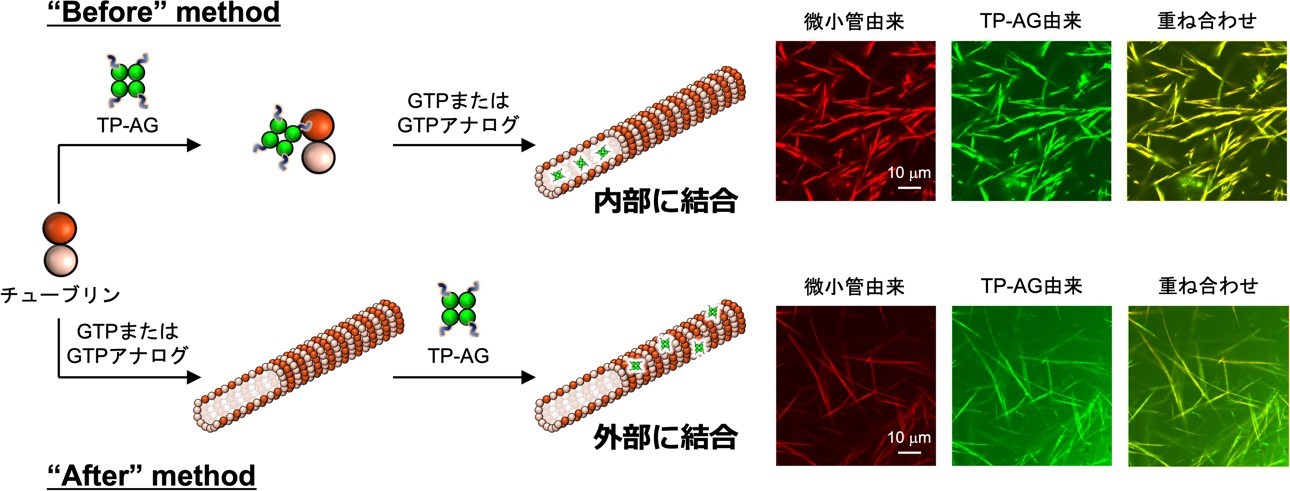
図 3. TP-AG の微小管への複合化法と共焦点レーザー蛍光顕微鏡像。どちらの方法も微小管に結合するが、条件に応じて結合位置が変化していた。
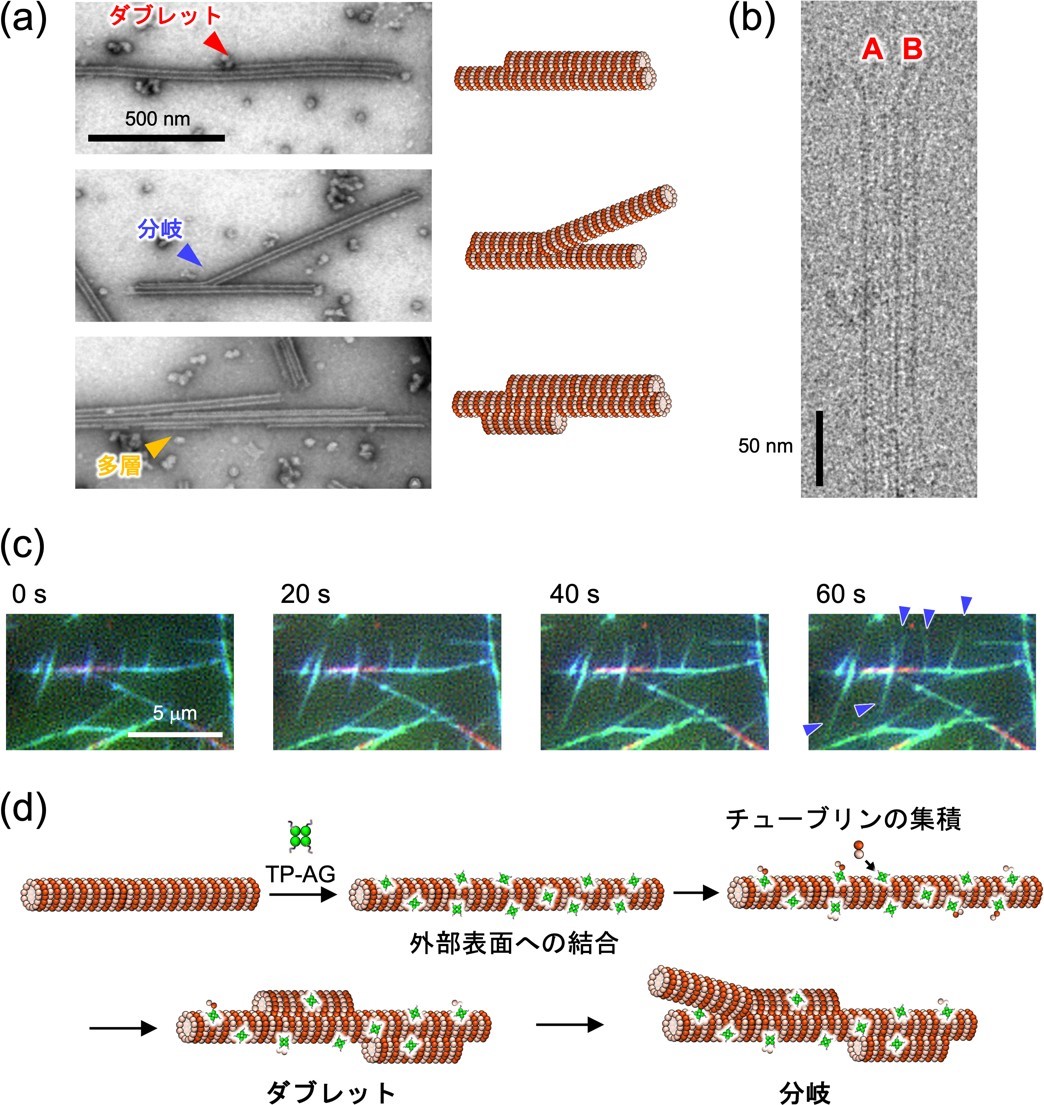
図 4. TP-AG の複合化による微小管超構造体の (a) ネガティブ染色電子顕微鏡像および (b) クライオ電子顕微鏡像。(c) 全反射照明蛍光顕微鏡による分岐構造の成長過程追跡。青矢頭は成長した分岐構造を表している。(d) ダブレットおよび分岐の推定形成メカニズム。
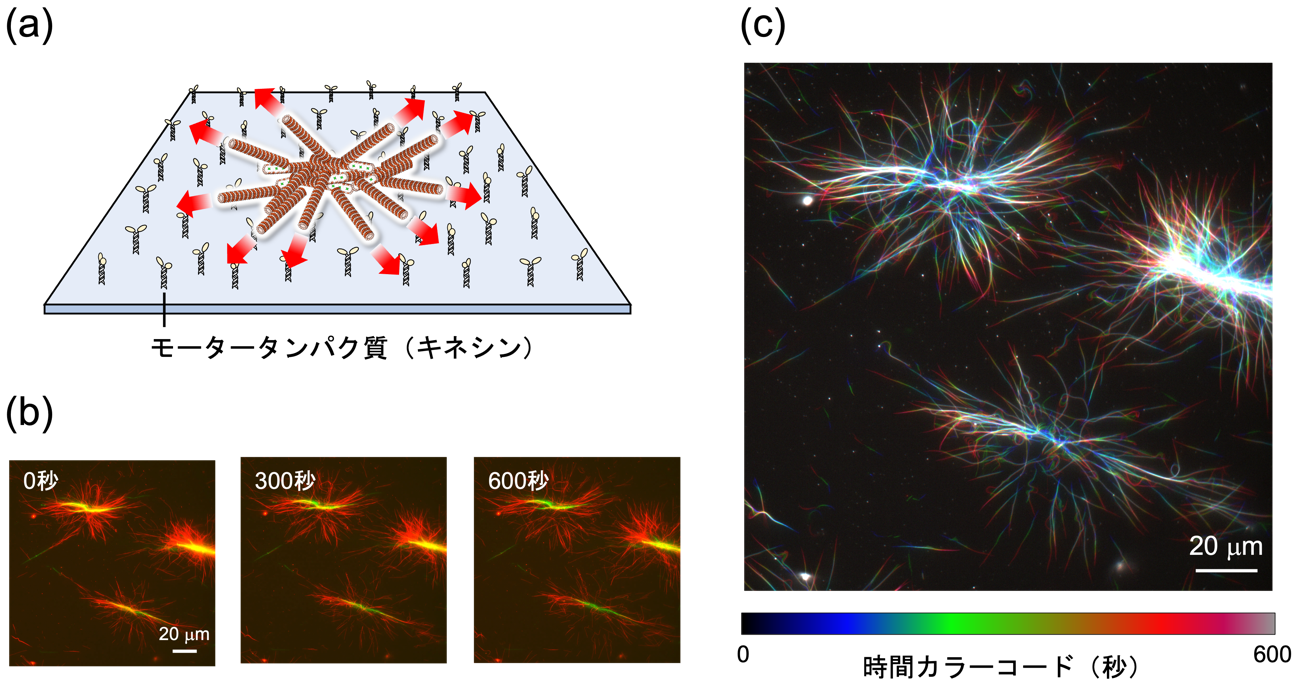
図 5. (a) TP-AG によって誘起されたアスター(放射上集合)構造。 (b) 蛍光顕微鏡像および (c) 撮影した動画を加工し、時間ごとに異なる色をつけて重ね合わせたもの。中心から外側に微小管が運動している様子が確認された。
【今後の展開】
本研究は外来タンパク質によって微小管超構造体を形成した初めての例であり、これまで未解明であった天然の微小管超構造体の形成メカニズムや物性の解明に大きく寄与すると考えられます。将来的には繊毛病などの微小管超構造体が関与する病態の理解につながる可能性があります。また、本研究で得られたダブレット微小管や分岐構造は通常の微小管とは異なる構造や性質を有するため、分子ロボットなどのナノ材料への応用が期待できます。微小管構造を極めて安定化することを利用した抗がん剤への展開も考えられ、幅広い分野への応用が期待されます。
【用語解説】
*1 微小管
チューブリンタンパク質から構成される、一般的に内径約 15 nm、長さ数μm〜数十μm のチューブ状集合体。細胞の形態維持や変化、細胞分裂、細胞内物質輸送、鞭毛や繊毛の運動などの多様な細胞機能に重要な役割を果たす。
*2 タキソール(別名パクリタキセル)
抗がん剤の一種であり、TP の結合部位と同じ微小管内部のポケットに強く結合する。タキソールの結合により微小管は極めて安定化され、脱重合が抑制されることで細胞が正常に分裂できず抗がん活性を示す。
*3 繊毛・鞭毛
真核生物の細胞から突出している微細な毛のような構造。波打ち運動をすることで、精子の運動などを可能とする。内部の中央に中心対微小管があり、周辺微小管(ダブレットなどの多重微小管)がそれらを取り囲むように並んでいる。
*4 Tau 由来ペプチド(TP)
本 研究グループによって開発された 、 微小管内部に結合する ペプチド
(CGGGKKHVPGGGSVQIVYKPVDL)(Chem. Eur. J., 2018, 24, 14958)。微小管関連タンパク質の一種である Tau から設計され、微小管内部に相当するチューブリンのポケットに結合する。
*5 Azami-Green(AG)
アザミサンゴより単離された、四量体構造を形成することで緑色蛍光を生じるタンパク質(A. Miyawaki et al., J. Biol. Chem., 2003, 278, 34167)。TP-AG はAG のC 末端に TP を導入し、AG 1 つあたり 4 つの TP を有する。
*6 微小管形成中心
動物細胞における細胞小器官の 1 つ。細胞内では微小管形成中心から微小管が伸長してアスター型構造を形成し、紡錘体形成などに関与する。
*7 His-tag
アミノ酸で一種であるヒスチジン(His)が連続した配列。タンパク質精製に汎用される。His-tag は微小管外部表面に結合することが示唆されており、今回は His が 6 個連続した配列を用いた。
*8 ネガティブ染色電子顕微鏡
試料そのものではなく、その背景を染色して電子顕微鏡で観察する手法。染色剤としてタンパク質よりも強く電子線を散乱させる重金属溶液(今回は酢酸ウラニル溶液)が用いられる。
*9 クライオ電子顕微鏡
溶液中の試料を急速凍結し、電子顕微鏡によって観察することで、生体内に近い状態での構造を観察することができる手法。ネガティブ染色電子顕微鏡と異なり染色を行う必要がない。
*10 全反射照明蛍光顕微鏡
カバーガラス上で励起光を全反射させることで生じるエバネッセント光を光源とした蛍光顕微鏡。背景に光ノイズの少ない状態での観察が可能であり、今回は微小管の分岐構造の形成をリアルタイムで追跡するために用いた。
【論文情報】
タイトル:Generation of stable microtubule superstructures by binding of peptide-fused tetrameric proteins to inside and outside
著者名:Hiroshi Inaba†*, Yurina Sueki†, Muneyoshi Ichikawa†, Arif Md. Rashedul Kabir, Takashi Iwasaki, Hideki Shigematsu, Akira Kakugo, Kazuki Sada, Tomoya Tsukazaki, Kazunori Matsuura*
†共筆頭著者、*共責任著者
掲載誌:Science Advances
DOI: 10.1126/sciadv.abq3817
【構造生命科学研究室】
https://bsw3.naist.jp/courses/courses309.html
https://bsw3.naist.jp/tsukazaki/
(2022年09月08日掲載)
 奈良先端科学技術大学院大学
奈良先端科学技術大学院大学