酵母による肝機能改善アミノ酸「オルニチン」の高生産に成功 合成酵素の制御機構を解除して実現 ~健康イメージを高めた発酵・醸造食品の生産に期待~
酵母による肝機能改善アミノ酸「オルニチン」の高生産に成功 合成酵素の制御機構を解除して実現 ~健康イメージを高めた発酵・醸造食品の生産に期待~
【概要】
奈良先端科学技術大学院大学(学長:横矢直和)先端科学技術研究科バイオサイエンス領域ストレス微生物科学研究室の高木博史教授らは、奈良県産業振興総合センター生活・産業技術研究部バイオ・食品グループの大橋正孝総括研究員との共同研究により、シジミに多く含まれるアミノ酸で、肝臓の働きを改善する効果が知られているオルニチンを酵母に、従来の約7倍の高い効率で生産させることに成功するとともに、生産量が増加する機構を明らかにしました。
酵母※1は発酵産業において広く利用されている微生物ですが、アミノ酸の生産に活用した例は未だ多くはありません。しかしながら、酵母を用いて製造される発酵・醸造食品や飼料などに含まれるアミノ酸の量を高めることができれば、製品の高付加価値化や発酵技術の高度化などに貢献できると考えられます。また、アミノ酸の一種であるオルニチン※2は、肝臓の解毒作用の促進、アルコール性疲労の抑制などの効果が報告されており、主に大腸菌などの細菌を用いた発酵法により生産されていますが、食品として高い安全性が認められている酵母を使えれば、有用性の高い技術になることが期待されます。
これまでに私たちは、既存の清酒酵母からオルニチンを高生産する菌株を分離し、この菌株の特許化およびオルニチンを多く含む清酒の商品化に成功しています。今回は、酵母のオルニチン生産性をさらに向上させる目的で、この菌株のオルニチン高生産メカニズムを初めて明らかにしました。
その結果、N-アセチルグルタミン酸キナーゼ(NAGK)という酵素の遺伝子に変異を見出し、この変異型NAGKを発現する酵母ではオルニチン含量が約7倍に増加することを明らかにしました。通常、オルニチンから合成されるアルギニンがNAGKをフィードバック阻害
して働きを抑えることによりオルニチンやアルギニンの過剰生産を防いでいますが、変異型NAGKではその仕組みが解除されていることを突き止めました。
これまでにオルニチンを高生産する酵母の事例はなく、従来にない新規な酵母を用いることで、健康イメージを付与した清酒・酒粕などの発酵・醸造食品を国内外の市場に提供することが可能となります。
この研究成果は、国際代謝工学会の学会誌であるMetabolic Engineering誌(オランダ)のオンラインサイトに2020年8月23日付で掲載されました。
高木博史教授のコメント

この研究は、当研究室に「研修員」として滞在した奈良県産業振興総合センターの大橋正孝総括研究員との共同研究成果であり、実験に協力した当研究室の那須野亮助教および磯貝章太博士研究員も交えて喜びを分かち合いたいと思います。今回、清酒酵母のような実用酵母で初めてオルニチンの合成制御機構を突き止め、それを遺伝的に解除することでオルニチンの高生産に成功したことは大きな成果です。また、本研究で育種した清酒酵母(特許取得済)で醸造した「オルニチン高含有清酒」がすでに奈良県内の酒造会社(八木酒造、菊司醸造、倉本酒造)で商品化されており、本学の産官学連携や社会実装への取り組み、研究力を強くアピールできると思っています。これまで基礎・応用のバランスを意識した研究を進めてきた当方にとっても代表的論文の一つになりました。今後、当研究室で確立した有用アミノ酸を高生産する酵母の育種技術を活用することで、様々な発酵・醸造食品の高付加価値化を目指したいと考えています。
【研究の背景】
近年、アミノ酸は細胞内や血漿などに遊離した形で存在し、生体内で重要な役割を果たしていることから、その生理機能が注目されており、様々な食品、飲料、化粧品に添加されています。例えば、オルニチン※2はシジミに多く含まれるアミノ酸で、肝臓の解毒作用の促進、アルコール性疲労の抑制、成長ホルモンの分泌促進などの効果が知られており、主に大腸菌やコリネバクテリウム属の細菌を用いた発酵法により生産されています。酵母※1のSaccharomyces cerevisiae(サッカロミセス・セレビシエ)は醤油、酒類、パン類などの発酵・醸造食品、バイオエタノールなどの製造に使用され、8兆円超と想定される巨大産業を支えている重要な微生物です。従って、食品として高い安全性が認められている酵母を用いてオルニチンを発酵生産することができれば、有用性の高い技術になることが期待されます。
清酒の主要な芳香成分(高級アルコール、エステル類)は酵母の発酵過程で主にアミノ酸から生成されることから、清酒の品質向上や酒質の差別化には、アミノ酸の組成や生成量に特徴を有する酵母の開発が重要です。私たちはこれまでに、一般的な清酒酵母(親株)に突然変異処理を施した後、プロリンのアナログ※4であるアゼチジ-2-カルボン酸を含む培地で生育できる変異株を分離することによって、プロリンおよびオルニチンを細胞内に高生産する株を取得しました。また、この株を用いて清酒を醸造すると、清酒中および酒粕中に親株に比べて3倍以上のオルニチンを含むことから、オルニチン高生産酵母に関する特許を取得しました。現在、この酵母を用いたオルニチン含量の多いユニークな清酒が奈良県の酒造会社(2017年:八木酒造株式会社、2019年:菊司醸造株式会社、2020年:倉本酒造株式会社)から商品化されています。
以上の背景から、本研究では、清酒酵母のオルニチン高生産株を解析し、オルニチンの高生産に関わる遺伝子の変異を同定するとともに、オルニチン高生産メカニズムの解明を行いました。
【研究成果】
オルニチンは、酵母のミトコンドリア内でグルタミン酸から数段階の酵素反応によって、生合成されます。ミトコンドリアで合成されたオルニチンは、細胞質に移行し、シトルリン、アルギノコハク酸、アルギニンを経て、再びオルニチンに変換されます(図1)。まず、清酒酵母のオルニチン高生産株について(図2)、次世代型シーケンサーを用いて全ゲノム解析を行い、オルニチンの高生産に寄与する可能性の高い遺伝子の配列を親株と比較しました。その結果、オルニチン高生産株にはN-アセチルグルタミン酸キナーゼ(NAGK)という酵素をコードするARG6遺伝子にアミノ酸置換(340番目残基のスレオニンがイソロイシンに置換;Thr340Ile)を伴う変異を見出しました。また、実験室酵母で変異型NAGKを発現させると、野生型NAGKの発現よりも細胞内のオルニチン含量が約7倍に増加しました(図3)。従って、ARG6遺伝子の変異がオルニチン高生産に寄与している可能性が強く示唆されました。
.png)
図1 酵母におけるオルニチンの代謝経路
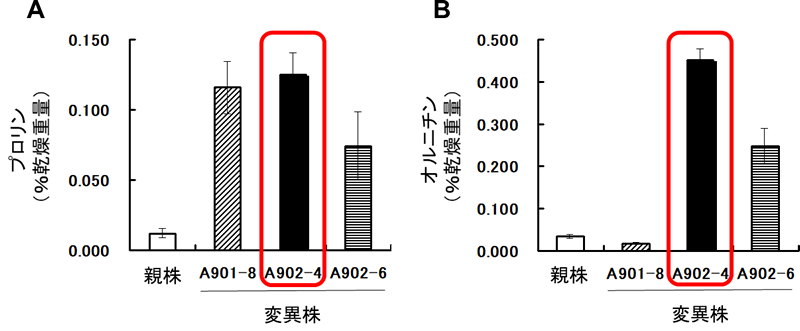
図2 清酒酵母の細胞内(A)プロリン・(B)オルニチン含量 本研究では赤枠の菌株(A902-4株)をオルニチン高生産株として解析した。
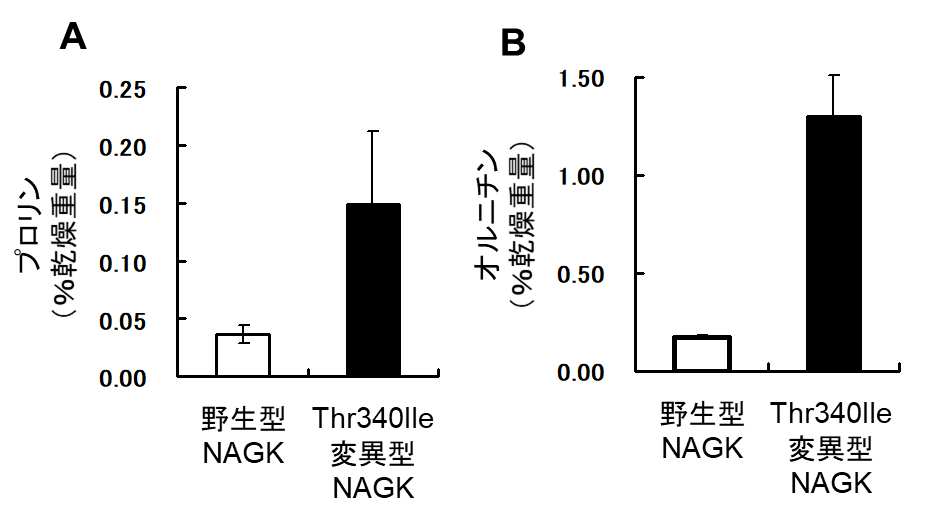
図3 野生型および変異型(Thr340Ile)のNAGKを発現する 実験室酵母の細胞内(A)プロリン・(B)オルニチン含量
次に、野生型および変異型のNAGKを大腸菌で発現させ、精製した後、酵素活性を測定しました(図4)。その結果、野生型NAGKでは、アルギニンを1 mM添加すると活性がほぼ消失しましたが、変異型NAGKでは、ほとんど活性が低下しませんでした。これらの結果から、野生型NAGKの活性はアルギニンによってフィードバック阻害を受けますが、アミノ酸置換(Thr340Ile)を有する変異型NAGKではフィードバック阻害が解除されることで、NAGK以降の反応がスムーズに進行し、オルニチンが過剰合成されることを初めて突き止めました。さらに、NAGK(PDB ID code: 3ZZH)のアルギニン結合部位近傍の構造を予測したところ、340番目残基のThrからIleへの置換に伴う局所構造の破壊がアルギニンによるフィードバック阻害解除の原因であると考えられました(図5)。
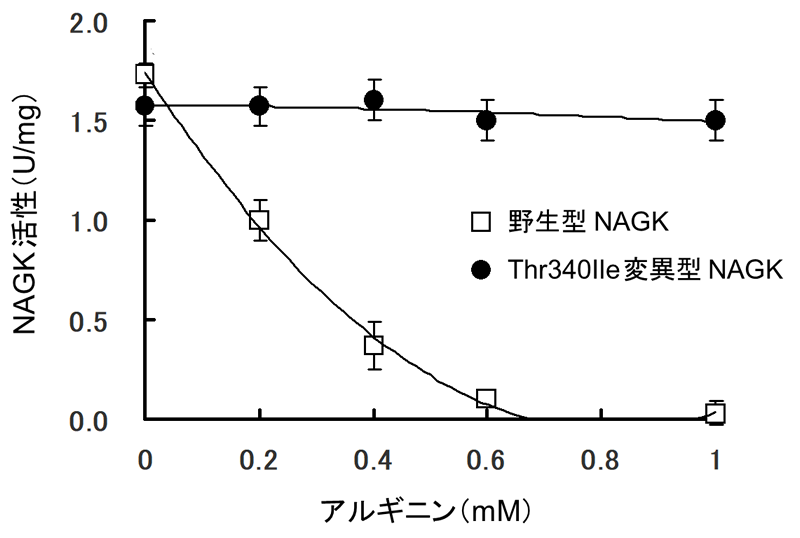
図4 アルギニン存在下における野生型および変異型NAGK活性
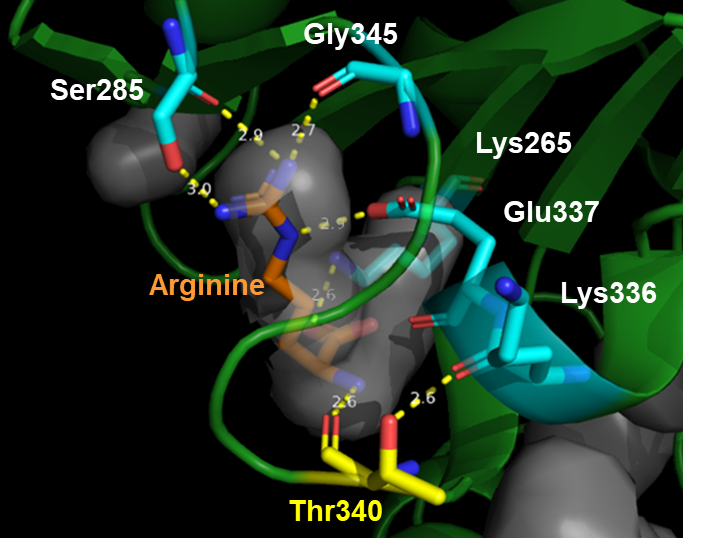
図5 NAGKにおけるアルギニン結合部位近傍の予測構造
また、オルニチン高生産酵母においては、オルニチンから合成されるアルギン含量は増加せずに、プロリン含量が増加していました。その理由としては、過剰合成されたオルニチンがオルニチントランスアミナーゼCar2という酵素によって、プロリン合成の中間体(Δ1 -ピロリン-5-カルボン酸)に変換され、それ以降の酵素反応により、プロリンが過剰合成された可能性が考えられます。
【本研究の意義】
今回の研究により、酵母のNAGKにアミノ酸置換(Thr340Ile)が導入されることで、アルギニンによるNAGKのフィードバック阻害が解除され、変異型NAGKを発現する酵母ではオルニチン含量が著しく増加することを初めて明らかにしました。また、このような変異型NAGKを発現する酵母をプロリンのアナログ(類似化合物)であるアゼチジン-2-カルボン酸に耐性を示す菌株を選んで取得したことから、「アゼチジン-2-カルボン酸耐性」がオルニチン高生産株の選抜・育種の指標になることが分かりました(特許取得済み)。
本研究で明らかにしたオルニチン高生産メカニズムに基づき、オルニチン生産量がさらに向上した酵母を取得することで、清酒・酒粕をはじめ、味噌・醤油などの醸造食品の高付加価値化(健康イメージのアップ)が可能となり、これまでにない機能性醸造食品を市場に数多く投入できると考えられます。また、オルニチン含量の高い醸造食品の開発によって、サプリメントを購入することなく、通常の食品からオルニチンの高摂取が可能となり、国民の豊かな食生活の実現に貢献することができます。
【今後の展開】
オルニチンやアルギニンの合成を制御しているNAGK(酵素タンパク質)内のアミノ酸残基を別のアミノ酸に置換し、酵素の活性や安定性を強化することで、オルニチンの生産量がさらに向上した酵母の取得、創製を目指します。
また、私たちは独自に見出したアミノ酸(プロリン、アルギニン、バリン、ロイシン、フェニルアラニン、システイン、リジン、グルタミン酸、オルニチンなど)の代謝制御機構や生理機能を解析するとともに、これらのアミノ酸を高生産する産業酵母(パン酵母、清酒酵母、泡盛酵母、醤油酵母)を育種し、酵母の高機能開発(発酵力向上、味・風味の多様化、健康イメージ付与など)に成功しています。特に、育種した酵母を用いて製造した泡盛はすでに3種類が商品化されています(2016年:HYPER YEAST 101、2018年:はなはな ハイビスカス酵母仕込み、2019年:尚 KAMIMURA)。このように、酵母を用いたアミノ酸の高生産に関する知見と技術は、様々な発酵・醸造食品(酒類、パン類、醤油、味噌、酵母エキスなど)の製造にとどまらず、バイオエタノールを含む主要な酵母利用産業の高度化・効率化に役立つことが期待されます。
また、アミノ酸は全生物の細胞内に共通して存在する分子であり、酵母や大腸菌などの微生物のみならず、植物、昆虫、動物などの高等生物の細胞内においても機能を有していると考えられます。現在、このような機能性アミノ酸※5を高生産させる育種手法を「アミノ酸機能工学」と名づけ、微生物、植物など様々な生物の高機能開発や有用物質生産に貢献できる技術としての確立を目指しています(図6)。
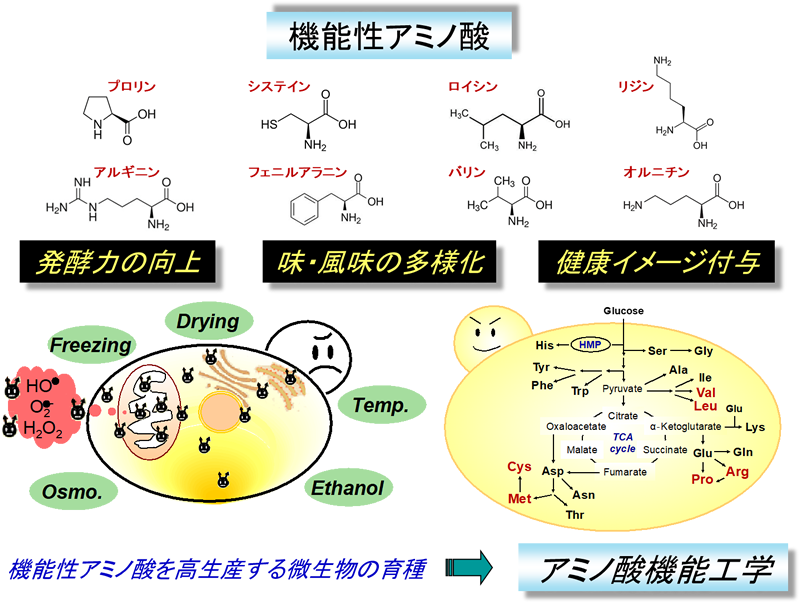
図6 機能性アミノ酸とアミノ酸機能工学
【用語説明】
※1 酵母
酵母のうち基礎研究のモデル株を実験室酵母という。実験室酵母では遺伝解析やゲノム解析による知見が蓄積され、遺伝子操作技術も確立しているが、発酵力は弱く発酵食品などの生産には不適である。一方、清酒、ビール、ワイン、パン、バイオエタノールなどの生産に用いられる菌株を産業酵母といい、発酵性や生育速度の優れた株が選択されているが、遺伝特性や倍数性が異なり、実験室酵母の知見や技術が活用されていない。本研究では、清酒酵母と実験室酵母を使用した。
※2 オルニチン
シジミに多く含まれ、肝臓の解毒作用の促進、アルコール性疲労の抑制などの効果が報告されているアミノ酸である。オルニチンを配合して肝機能改善を訴求する食品は、健康美容食品市場の3.6%(約640億円; 2010年)を占める大きな市場を形成している。これまでの育種・醸造技術において、オルニチンを高生産する酵母の事例はなく、従来にない新規な酵母を用いてオルニチン含量の多い清酒を醸造することで、健康イメージを付与し、付加価値を高めた清酒・酒粕を市場に提供することが可能となる。
※3 フィードバック阻害
代謝経路の最終産物(本研究ではアルギニン)が初発反応の酵素(本研究ではN-アセチルグルタミン酸キナーゼ)に結合し、その酵素の活性を阻害すること。野生型の細胞では、この仕組みによって最終産物が過剰に合成されないように厳密に調節されている。初発反応の酵素を遺伝的に改変し、フィードバック阻害を解除することで、最終産物の過剰合成(高生産)が可能になる。
※4 アナログ
アナログとはアミノ酸と構造や性質が類似している化合物のことを言う。細胞内で対応するアミノ酸と競合してタンパク質に取り込まれ、構造や機能が損なわれたタンパク質を生成することで、生育阻害・細胞死を引き起こすものもある。その場合、アナログを含む培地で生育できる株(耐性株)を分離すると、対応するアミノ酸を細胞内外に著量生産していることが多い。本研究では当初、プロリンの高生産株の取得が目的であったため、プロリンのアナログであるアゼチジン-2-カルボン酸を使用した。
※5 機能性アミノ酸
私たちはプロリン、グルタミン酸、リジン、アルギニンのように細胞へのストレス耐性付与やタンパク質の保護、分岐鎖アミノ酸(バリン、ロイシン、イソロイシン)や含硫アミノ酸(システイン、メチオニン)のように味・香気成分の生成に関わるアミノ酸と、オルニチンや必須アミノ酸(リジン、分岐鎖アミノ酸)のように健康機能の維持・向上に役立つアミノ酸を「機能性アミノ酸」と名付けている。
【掲載論文】
論文タイトル:High-level production of ornithine by expression of the feedback inhibition-insensitive N-acetyl glutamate kinase in the sake yeast Saccharomyces cerevisiae (清酒酵母におけるフィードバック阻害非感受性型N-アセチルグルタミン酸キナーゼの発現によるオルニチン高生産)
著者:Masataka Ohashi*, Ryo Nasuno, Shota Isogai, Hiroshi Takagi (大橋 正孝*、那須野 亮、磯貝 章太、高木 博史)
所属:奈良先端科学技術大学院大学、*奈良県産業振興総合センター
掲載誌:Metabolic Engineering
【原著論文】
https://www.sciencedirect.com/science/article/pii/S1096717620301257
https://www.sciencedirect.com/sdfe/reader/pii/S1096717620301257/pdf
【ストレス微生物科学研究室】
研究室紹介ページ:https://bsw3.naist.jp/courses/courses305.html
研究室ホームページ:https://bsw3.naist.jp/takagi/
(2020年08月27日掲載)
 奈良先端科学技術大学院大学
奈良先端科学技術大学院大学