植物の"水道"の形成を制御するタンパク質の機能を明らかに~ 細胞壁形成の制御機構の解明へ大きな前進~
植物の"水道"の形成を制御するタンパク質の機能を明らかに~ 細胞壁形成の制御機構の解明へ大きな前進~
【本研究のポイント】
・細胞壁注1)形成の制御が植物細胞の機能と植物の生育に重要である。
・タンパク質 MIDD1注2)が凝集して微小管注3)を分解し、細胞壁の形成を局所的に抑制することで道管注4)を形成する、という仕組みを明らかにした。
・細胞壁形成、および真核生物が広くもつ微小管の、制御機構の理解が大きく前進した。
【研究概要】
国立大学法人東海国立大学機構 名古屋大学大学院理学研究科の貴嶋 紗久 研究員(当時※1)、佐々木 武馬 助教、高谷 彰吾 研究員、浅野 僚介 学部生、小田 祥久 教授の研究グループは、大学共同利用機関法人 情報・システム研究機構 国立遺伝学研究所遺伝形質研究系の比嘉 毅 特任研究員(当時※2)、大学共同利用機関法人自然科学研究機構 生命創成探究センターの近藤 洋平 助教、国立研究開発法人理化学研究所 環境資源科学研究センターの若崎 眞由美 テクニカルスタッフⅡ、佐藤 繭子 技師、豊岡公徳 上級技師、奈良先端科学技術大学院大学 先端科学技術研究科の出村 拓 教授、京都先端科学技術大学 バイオ環境学部の福田 裕穂 学部長(当時※3)との共同研究により、植物の水の輸送路である道管の形成に必要な新たな機構を明らかにしました。
研究グループは、シロイヌナズナの道管においてMIDD1タンパク質が液―液相分離注5)を介して凝集体を形成し、細胞壁形成の足場となる微小管を分解する機能をもつことを突き止めました。この MIDD1 タンパク質の機能が細胞壁の形成を局所的に抑制することで、道管の水の輸送路を確保していることを明らかにしました。この知見は植物の細胞壁形成の制御機構の理解を飛躍的に深めるものです。
植物の細胞を覆う細胞壁は、細胞の形の制御、水分・養分の輸送経路の確保など多様な機能を担います。細胞壁形成の適切な制御は植物細胞が機能を発揮する上で重要です。本研究の知見は、細胞壁形成を人為的に制御し、植物の形態や硬さを制御する新技術につながることが期待されます。また、本研究で明らかとなった液―液相分離を介して微小管を分解する機構は、真核生物に共通して存在する微小管の制御機構の解明に大きく貢献すると考えられます。
本研究成果は 2024 年1月3 日午後7時(日本時間)付イギリスの科学誌「Nature Plants」誌で公開されました。
【研究背景と内容】
植物細胞はセルロースを主成分とした細胞壁を細胞表面に形成しています。この細胞壁は植物細胞の成長や、形態の維持、体内の水輸送路の確保など、広範な現象の役割を担い、細胞壁形成の適切な制御は植物の発生と生存に不可欠です。細胞壁の形成は細胞の表面で均一ではなく、適切なタイミングで適切な場所に起こるように制御されています。細胞膜の直下に並ぶ微小管はセルロースを合成する酵素が進む位置と方向を導くことにより、細胞壁を形成する場所を決定しています。
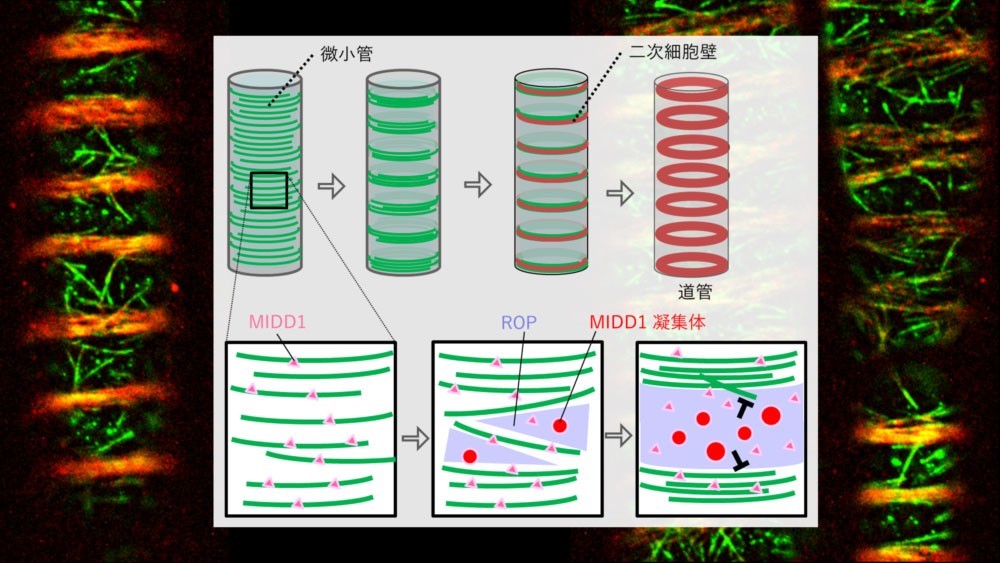
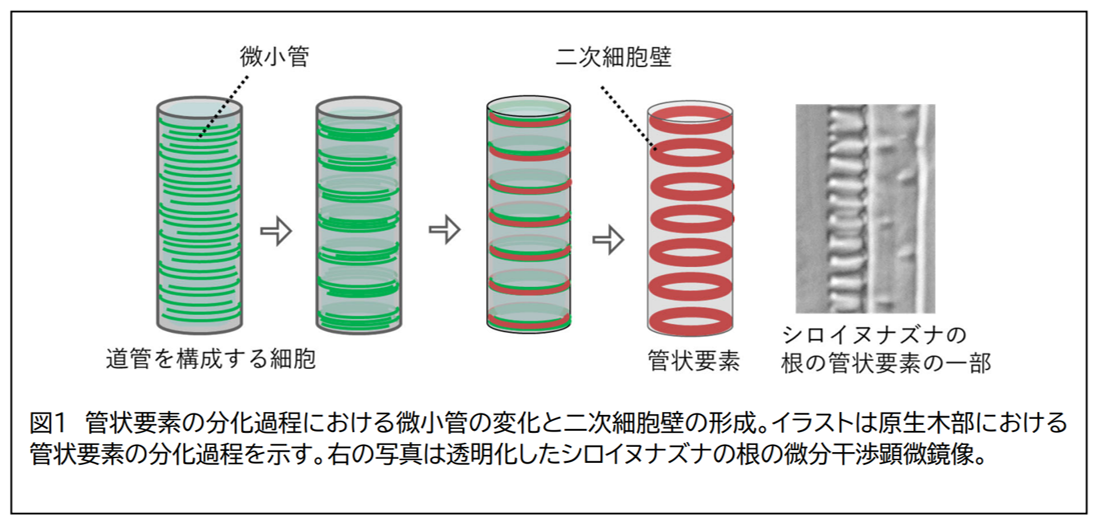
植物の道管を構成する細胞は、微小管を局所的に配置させ、二次細胞壁と呼ばれる厚い細胞壁の形成を誘導することにより、水の輸送に適した構造を作り出します。二次細胞壁を形成した後、道管を構成する細胞はプログラム細胞死により細胞内容物を消化し、管状要素あるいは道管要素と呼ばれる、水を輸送するための中空の管になります(図1)。
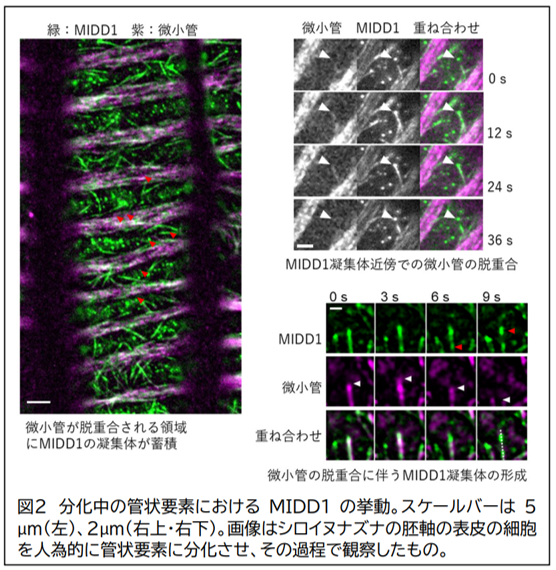
これまでに本研究グループは、道管を構成する細胞において、MIDD1 タンパク質が微小管の局所的な配置に関与していることを明らかにしていましたが、その詳細なメカニズムは不明でした。本研究では、細胞が管状要素に分化する過程での MIDD1 タンパク質の挙動を詳細に解析しました。その結果、分化初期において MIDD1 タンパク質が微小管に局在し、その後次第に細胞膜上で凝集体を形成しはじめ、微小管が脱重合注6)される領域に多数の凝集体として存在することが分かりました(図 2 左)。この凝集体と微小管の挙動を詳しく解析したところ、微小管が MIDD1 タンパク質の凝集体の近傍において高い確率で脱重合されることが分かりました(図 2 右上)。MIDD1タンパク質が凝集体を形成する瞬間を追跡したところ、微小管に相互作用したMIDD1が、微小管の脱重合に伴って凝集体を形成する様子が観察されました(図 2 右下)。さらに、一度形成された凝集体は、相互に融合することが可能であり、MIDD1タンパク質は凝集体の内部と外部(細胞質)とを行き来していることも分かりました。タンパク質の凝集を阻害する薬剤で細胞を処理したところ、MIDD1 の凝集体形成が抑制され、微小管が分解される領域が狭まりました。これらの結果は、MIDD1 が液―液相分離と呼ばれる現象により細胞質中に凝集体を形成し、微小管の脱重合を促進している可能性を示唆しました。
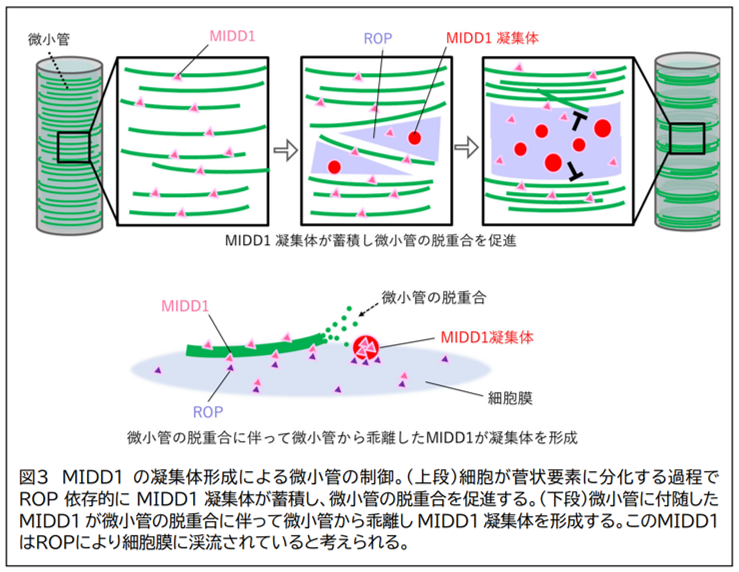
MIDD1 は細胞膜に存在する低分子量 GTP アーゼである ROP タンパク質、微小管の脱重合活性を持つ Kinesin- 13A タンパク質と相互作用することが分かっていました 。 そこでROP と Kinesin-13A のはたらきを調べたところ、脱重合される領域に ROP が蓄積し 、MIDD1 の凝集体形成を促進していること、さらに MIDD1 がKinesin-13A を伴って凝集体を形成していることが分かりました。MIDD1、ROP、Kines in-13Aのいずれかのタンパク質を欠いた変異体では、野生型に比べて微小管が脱重合される領域が狭まり、二次細胞壁が密に形成されていました。このことは、これらのタンパク質による微小管の分解が局所的に二次細胞壁形成を抑制していることを示しています。
MIDD1タンパク質の構造を調べたところ、MIDD1 タンパク質はN末端に天然変性領域注7)を有し、この領域が微小管との相互作用およびMIDD1の凝集体形成、さらには道管における二次細胞壁形成の局所的な抑制に必要であることが分かりました。
【成果の意義】
植物の細胞壁の形成は細胞膜近傍の微小管によって制御されていますが、特定の場所で微小管を壊したり残したりする仕組みはほとんど分かっていません。本研究は MIDD1 タンパク質の液―液相分離を介した凝集体形成が局所的に微小管の脱重合を誘導し(図3)、これにより局所的な細胞壁形成の抑制をもたらすという、まったく新しい細胞壁形成の制御機構を世界に先駆けて解明しました。この知見は植物の細胞壁形成の制御機構理解を飛躍的に深めるものです。このMIDD1の性質を利用することにより、細胞壁形成を人為的に制御し、植物の葉や果実等の形態や硬さを制御する新技術に繋がることが期 待されます。さらに、道管の構造は植物の乾燥ストレス耐性に関わっていることが報告されています。MIDD1 の性質を利用することにより、植物の乾燥ストレス耐性を向上させる技術にもつながる可能性が考えられます。また、微小管は植物に限らず真核生物に広く保存された細胞内構造であり、抗がん剤のターゲットにもなる重要な構造です。タンパク質が液―液相分離を介して微小管を脱重合する機構は、これまで真核生物で広く研究されてきた微小管の制御機構の中でも例が無く、微小管の制御機構の解明に大きく貢献する知見です。
本研究は、文部科学省の科学研究費補助金『19H05670』、『19H05677』、日本学術振興会の科学研究費補助金『21H02514』、『20K21435』、『23K18126』、公益財団法人三菱財団自然科学研究助成の支援のもとで行われたものです。
※1 2023 年 4 月より国立研究開発法人 産業技術総合研究所 生物プロセス研究部門 研究員
※2 2022 年 4 月より国立大学法人 東京大学 総合文化研究科 特任研究員
※3 2023 年 4 月より公立大学法人 秋田県立大学 学長
【用語説明】
注 1)細胞壁:
植物の細胞膜の外側に形成され、植物細胞の形態や機能を決定づける構造。主にセ ルロース、ヘミセルロース、ペクチンから成る。道管や仮道管、繊維の細胞壁にはこ れらに加えてリグニンが沈着する。
注 2)タンパク質 MIDD1:
維管束植物が保有するタンパク質の一つ。N 末端に天然編成道管での細胞壁形成および葉での細胞分裂の制御に関わっていることが報告されている。
注 3)微小管:
チューブリンと呼ばれるタンパク質が重合することで作られる直径 24 ナノメートルのチューブ状構造。細胞分裂や細胞内輸送など多様な機能を担う。植物細胞では細胞表層に並び、細胞壁の主成分であるセルロースの合成を導いている。
注 4)道管:
植物が根から吸収した水分と養分を、植物の地上部に運ぶための管状の組織。注 5)液―液相分離:
2種類の液体が水と油のように分離する現象。細胞内では様々な分子が液―液相分離により液滴のような凝集体を形成し、細胞の機能を支えている。
注 6)(微小管の)脱重合:
微小管を構成するチューブリンタンパク質が微小管の端から脱落して微小管が短くなってゆくこと。
注 7)天然変性領域:
タンパク質の中で整った三次元構造をとらない領域。タンパク質が液―液相分離を起こす性質と深く関わっていることが知られる。
【論文情報】
雑誌名:Nature Plants
論文タイトル:Microtubule-associated phase separation of MIDD1 tunes cell wall spacing in xylem vessels in Arabidopsis thaliana
著者:比嘉 毅、*貴嶋 紗久、*佐々木 武馬、*高谷 彰吾、*浅野 僚介、近藤 洋平、若崎 眞由美、佐藤 繭子、豊岡 公徳、出村 拓、福田 裕穂、*小田 祥久 (*名古屋大学関係者)
DOI:10.1038/s41477-023-01593-9
URL: https://www.nature.com/articles/s41477-023-01593-9
【植物代謝制御研究室】
研究室紹介ページ:https://bsw3.naist.jp/courses/courses104.html
研究室ホームページ:https://bsw3.naist.jp/demura/
(2024年01月10日掲載)
 奈良先端科学技術大学院大学
奈良先端科学技術大学院大学