異常タンパク質を見つけ出するメカニズムを解明
生物は数千~数万種類のタンパク質を作っている。すべてのタンパク質は多数のアミノ酸が連なったひも状の分子として合成され、正しい形に折り畳まれることにより、正常な機能を発揮する。折り畳みが異常なタンパク質が蓄積した場合、それをセンサー分子が検知して、異常タンパク質の修復や処理を促す命令を細胞に発信することが知られている。しかしこれまでは、どのような仕組みで異常タンパク質の蓄積が検知されるのかは不明であった。今回の研究では、代表的なセンサー分子であるIre1が異常タンパク質と直接的に結合して活性化することが明らかになった。
細胞内小器官のひとつである小胞体は、細胞外で働くべきタンパク質の折り畳みを担っている。細胞がさまざまな異常環境に晒されると、小胞体の働きに障害が生じ、異常なタンパク質が大量に生み出される。小胞体に存在するセンサー分子Ire1はこの状態を検知して活性化し、異常タンパク質の修復や分解を行う分子の合成量を増大させる。今回の研究の結果提示されたモデルでは、Ire1分子は異常時には多数が集合する。そして、集合したIre1分子に異常タンパク質が直接結合することにりIre1が活性化する。
異常タンパク質の蓄積は糖尿病やアルツハイマー病など多くの病気の誘因になるものであり、異常タンパク質検知の仕組みを明らかにする今回の研究は、これら疾患の病因解明や治療にも貢献できると期待される。
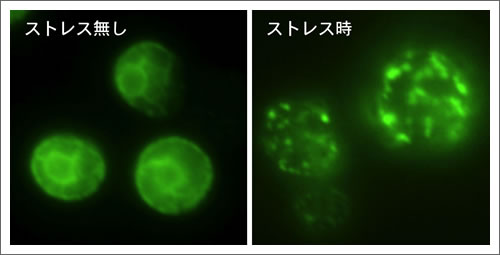
図 ストレス(異常タンパク質蓄積)に伴うIre1の集合
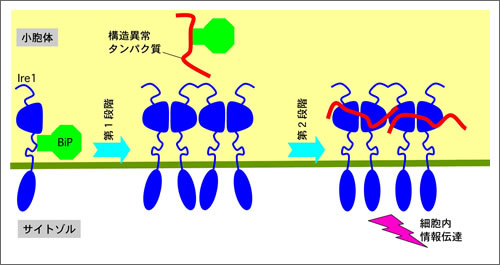
図 本研究により明らかになったIre1の二段階活性制御
掲載論文
Kimata, Y., Ishiwata-Kimata, Y., Ito, T., Hirata, A., Suzuki, T., Oikawa, D., Takeuchi, M., and Kohno, K. (2007) Two regulatory steps of ER-stress sensor Ire1 involving its cluster formation and interaction with unfolded proteins. J Cell Biol 179, 75-86.
(2007年10月15日掲載)
 奈良先端科学技術大学院大学
奈良先端科学技術大学院大学