私たちの研究室では、自然免疫に関する研究を行っています。
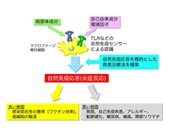
自然免疫は病原体の感染初期に作動する生体防御システムであり、おもにマクロファージや樹状細胞といった抗原提示細胞により担われます。これら自然免疫担当細胞は病原体の侵入を察知すると、延焼性サイトカイン、I型インターフェロン、ケモカインなどの液性因子の放出、活性酸素や一酸化窒素の産生を誘導し、炎症や抗ウイルス反応の惹起、感染局所への免疫細胞の動員、貪食や殺菌等を行います。さらに重要なことに、樹状細胞は自然免疫受容体を介して活性化、成熟することで適切なT細胞応答を誘導します。つまり、自然免疫は病原体に対する初期応答に加えて、獲得免疫系発動の司令塔としての役割も果たしています。
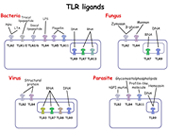
自然免疫による病原体認識機構に関する研究は、1996年のショウジョウバエにおけるTollと呼ばれる膜型分子の発見と1998年のほ乳類におけるToll様受容体(Toll-like receptor; TLR)ファミリーの発見(いずれも2011年ノーベル賞)を機に、急速に進みました。TLRはヒトで10種類(TLR1-10)、マウスで12種類(TLR1-9, 11-13)存在しており、それぞれが異なる病原体成分(例:細菌のリポ多糖、リポ蛋白質、フラジェリン蛋白質やウイルスのRNAやDNAなど)を認識する受容体として機能していることが大阪大学審良教授らによる先駆的な研究により明らかになりました (図1)。
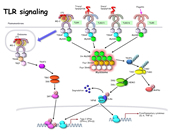
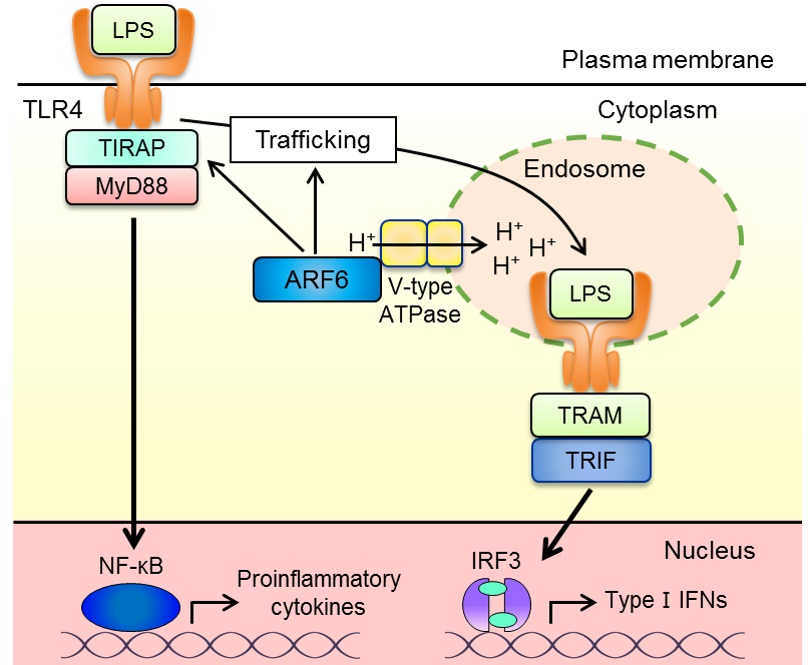
TLRはMyD88と呼ばれるアダプター分子を介して細胞内シグナル伝達経路を活性化し、炎症性サイトカインやI 型インターフェロンといったサイトカインの産生を促します (図2)。
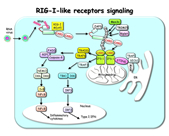
また、TLR以外にも、RIG-I-like receptor (RLR)ファミリー、Nod-like receptor (NLR)ファミリー、インフラマゾーム、DNAセンサー群、C-type lectin receptor (CLR)等が病原体認識を認識する自然免疫受容体として同定されています。RLRは細胞質内においてウイルスRNAの認識に関わるセンサーであり、RIG-IやMDA5と呼ばれるRNAヘリカーゼが知られています。これらRLRはそれぞれ異なるタイプのRNA型ウイルスに由来するRNAを認識し、一連の細胞内シグナル伝達経路の活性化を経て、最終的にウイルスに対する生体防御において中心的や役割を果たすI型インターフェロンの産生を誘導します (図3)。
インフラマゾームは細菌やウイルスの感染や、細胞ダメージに伴い活性化され、Caspase-1を介して、炎症性サイトカインIL-1β前駆体の切断と細胞外への放出を促進する複合体であり、NLRファミリーに属するNLRP3、IPAF、NLRP6、NLRC5などがその認識コンポーネントとして機能しています。また、細胞内にはDNA認識に関わる複数のDNAセンサー(cGAS、IFI16、MRE11、AIM2、DAIなど)が存在しており、ウイルスや細菌DNAの細胞質内や核内への侵入を察知するセンサーとして機能しています。CLRは主に真菌や死細胞産物に対する認識受容体として機能しており、MincleやDectin-1/2が知られています。
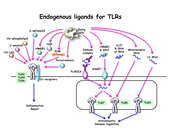
最近の研究から、こうした自然免疫受容体は病原体のみならず、細胞障害、感染、病態に伴い細胞外へと放出あるいは細胞内で蓄積するような自己成分 (長鎖ゲノムDNA、ミトコンドリアDNA、RNA、尿酸結晶、βアミロイド、酸化コレステロール、熱ショック蛋白質、細胞外マトリックス) や病原体以外の環境因子 (花粉やシリカなどのアレルゲン、アスベストなどの発ガン物) にも応答することが示唆されています (図4)。こうした反応は、自己免疫疾患、癌、アレルギー、アルツハイマー病、てんかん発作、動脈硬化といった疾患の発症や悪化に寄与すると考えられます。
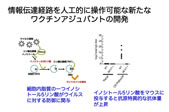
こうした重要性から、現在、自然免疫受容体を基盤とした研究は、感染症や癌に対する効率的なワクチンアジュバントの開発、抗炎症剤や抗アレルギー剤の開発、様々な炎症関連疾患や自己免疫疾患の治療に繋がることが期待される一大分野へと発展を遂げています (図5)。
主な研究テーマ
1)自然免疫受容体を介したシグナル伝達
TLR、RLR、NLRを介した自然免疫応答を制御する分子のスクリーニング、分子間相互作用、転写ネットワークなどを独自のアプローチにより解析しています。また、遺伝子改変マウスを作成することで生体レベルでの機能を明らかにしようとしています。
キーワード: TLR、RLR、NLR、遺伝子改変マウス
2)自己成分に対する自然免疫認識機構
自然免疫は病原体のみならず傷害を受けて死んだ細胞の成分に対しても応答し、炎症性疾患や自己免疫疾患を誘導することが分かってきました。しかしながら、これら自己成分がどういった機構(分解、切断、修飾、構造変化、局在変化など)で自然免疫受容体のアゴニストとして質的あるいは量的に変化するのかその破綻機構については不明です。私たちは、こうした自己成分認識や炎症誘導メカニズムの理解を目指しています。
キーワード: PAMPs、DAMPs、インフラマソーム、自己炎症性疾患、自己免疫疾患
3)新たな免疫制御法の確立
自然免疫受容体やシグナル伝達経路を制御可能な人工合成物 (核酸、蛋白質、脂質など) を用いた疾患制御や免疫賦活化の開発を目指しています。
キーワード: ワクチン、アジュバント、CircRNA
4)ドライ解析を用いたスクリーニング
様々なデータベースに登録されている自己免疫疾患患者由来のデータを下にした再解析データから新規疾患関連遺伝子の探索や治療法の確立を目指しています。
キーワード: 次世代シーケンス、RNA-seq、ChIP-seq、ATAC-seq、scRNA-seq、
最近の研究成果の紹介
Zou J, Immunity, 38, 717, 2013
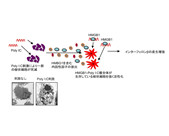
ウイルスRNAを模倣する合成二本鎖RNAアナログのPoly I:Cによる樹状細胞の活性化に関する解析を行い、Poly I:Cにより誘導される一部の樹状細胞の細胞死が、周囲の樹状細胞の活性化に深く関与していることを見出した。樹状細胞においては、RNAを認識するRIG-I-like receptorsおよびアダプター因子IPS-1を介したシグナル伝達経路が重要な役割を果たす。Two-hybrid screeningおよび免疫沈降法から、IPS-1の結合因子としてCathepsin Dを新たに同定した。Cathepsin Dはリソソーム内に局在する分解酵素であるが、Poly I:Cを取り込んだ樹状細胞においてはリソソームの膜が損傷するために、Cathepsin Dがリソソームから漏出する。細胞質に流入したCathepsin Dは、IPS-1と結合することにより、Poly I:Cにより誘導される自然免疫応答を促進する。Poly I:Cは、IPS-1-Cathepsin Dを介し、ネクロプトーシスと呼ばれる細胞死を誘導することで、核酸結合因子の一つHMGB1の放出を促す。死細胞から放出されたHMGB1とPoly I:Cは複合体を形成し、効率よく周囲の樹状細胞に取り込まれることで、自然免疫応答をさらに活性化する。このポジティブループにより、Poly I:Cは樹状細胞を介した獲得免疫の活性化を強く誘導する。Poly I:Cはワクチンのアジュバントとしても期待されていることから、本研究は自然免疫を介した獲得免疫活性化の分子機序を解明したことに加えて、新たな免疫賦活化法や樹状細胞療法を開発する上での基盤となるものである。(図6)
Kawasaki T, Cell Host Microbe, 14, 148, 2013
ウイルス感染後のI型インターフェロン産生制御に関わる細胞内因子としてリン脂質の一つフォスファジヂルイノシトール5リン酸(PI5P)を同定した。PI5Pはウイルス感染に伴い細胞内でのレベルが上昇し、その後転写因子IRF3と結合することを見出した。この結合により、IRF3リン酸化酵素TBK1が近接し、その結果IRF3のリン酸化が誘導され活性化されることが明らかとなった。また、PI5Pの産生を促すリン酸化酵素としてPIKfyveを同定した。興味深いことに、合成PI5P刺激は樹状細胞からのサイトカイン産生を誘導し、マウス生体への投与により抗原特異的抗体の産生を増加させる獲得免疫賦活作用を持つことが明らかとなった。新たなタイプのワクチンアジュバントとしての応用が期待される。(図7)
Kawasaki T, The EMBO Journal, 36, 1707, 2017
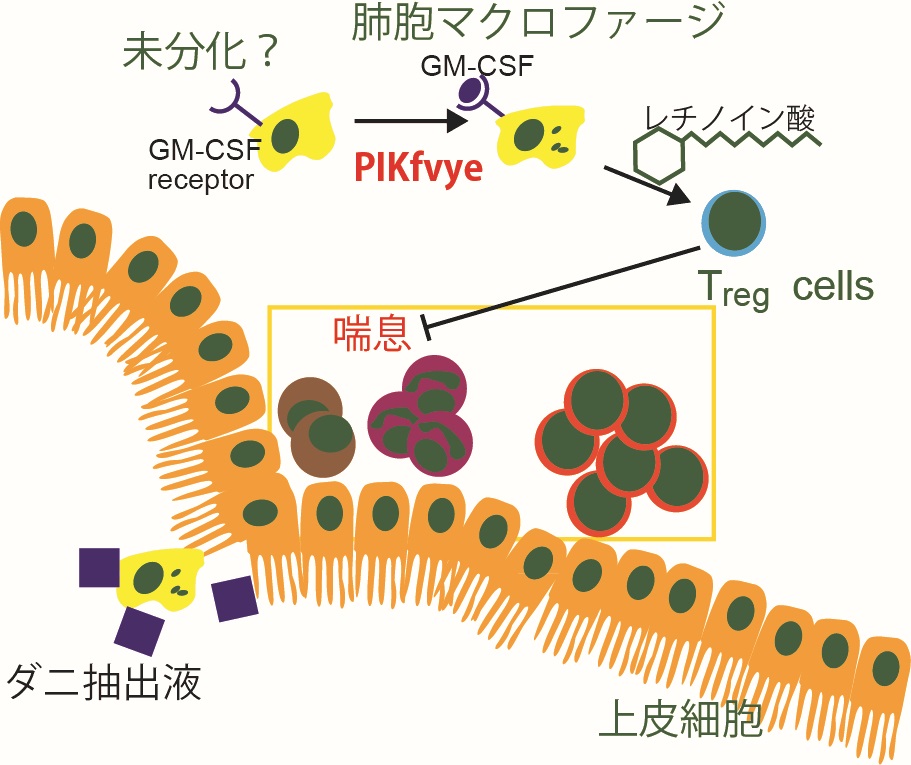
肺胞マクロファージは組織常在型マクロファージの一種であり、肺における免疫応答や恒常性維持において必須の細胞集団である。本研究では、PIKfyveが肺胞マクロファージの分化およびその機能において重要な役割を果たしていることを明らかにした。PIKfyveを欠損させたマウスでは、肺胞マクロファージの分化に必須のシグナル伝達機構に異常が見られるとともに、ハウスダストの一種であるイエダニ抽出物に暴露させた場合に、好酸球やリンパ球の浸潤を伴うアレルギー性気管支喘息症状や肺の炎症の増悪が観察された。さらに興味深いことに、PIKfyveを欠損したマウスにおいては、炎症反応を負に制御する機能を持つ制御性T細胞の肺への動員に異常が見られ、このことが炎症反応の増悪化に影響を及ぼしている可能性が示唆された。本研究により、肺胞マクロファージの機能を調節することにより、アレルギー症状を含む肺における炎症反応を制御するといった新たな治療法への応用が期待できる。(図8)
Murase M, The Journal of Immunology, 200, 2798, 2018
村瀬(図9)