細胞表面の突起がちぎれて生じる細胞外小胞は
タンパク質を高効率に送達していた
ー 遺伝子編集酵素も機能的に輸送可能に ー
老化やがんの研究を促進する発見に期待
細胞表面の突起がちぎれて生じる細胞外小胞は
タンパク質を高効率に送達していた
ー 遺伝子編集酵素も機能的に輸送可能に ー
老化やがんの研究を促進する発見に期待
【概要】
奈良先端科学技術大学院大学(学長:塩﨑一裕) 先端科学技術研究科 バイオサイエンス領域の末次志郎教授、西村珠子准教授、藤岡敏史大学院生(研究当時)を中心とした研究グループは、ジョンズ・ホプキンス大学の井上尊生教授、岐阜大学及び国立がん研究センター研究所の鈴木健一教授ら、東京大学の濡木理教授らの研究グループと共同で、細胞突起(フィロポディア)(注 1)から放出される膜状の構造物である細胞外小胞(extracellular vesicle(s):EV(s))による高効率なタンパク質送達の仕組みを明らかにしました。
EV は脂質二重膜からなる微小な膜小胞で、タンパク質や RNA を包みこみ、細胞間で輸送することにより、老化やがんなどの生理的・病理的過程に関与することが知られています。これまで主に、細胞内の物質を包む膜構造物のエンドソームに由来し外部に放出される EV が研究・応用されてきましたが、タンパク質を機能的な形で効率よく送達することは困難でした。
末次教授の研究グループはこれまでに、細胞表面の突起がちぎれて生じる EV が、細胞間でタンパク質を輸送し、細胞の性質を制御する新たな機構を見いだしていました。今回の研究では、この突起由来 EV が実際に運搬するタンパク質量の絶対量を測定し、その量が細胞の性質を変化させるのに十分であることを示しました。さらに、細胞突起を構成するタンパク質とゲノム編集酵素を融合させることで、EV に酵素を効率的に搭載し、受容細胞に送達できることを実証しました。これらの結果から、突起由来 EV はエンドソーム由来 EV よりも高効率なタンパク質送達が可能であることが示唆されました。
この成果は、EV 形成機構の理解を深め、老化やがんとの関連研究に新たな知見を提供するとともに、EV を介した細胞操作技術の基盤を築くものです。
本研究成果は、英国の学術誌『Nature Communications』に 2025 年 12 月 8 日(月)午後 7 時(日本時間)に掲載されます(DOI: 10.1038/s41467-025-66351-1)。
【研究の背景と経緯】
細胞外小胞(EV)は、老化やがんなどの疾患に伴いその量や性質が変化することから、近年、生体情報伝達や疾患バイオマーカーとして注目されています。脂質膜(注 2)で構成された EV は血液中にも存在し、がん細胞の転移や免疫応答の制御にも関与します。
従来、EV は主に細胞内部のエンドソームから形成され、細胞外に放出される経路が知られていました。一方で、ウイルスのように細胞表面から出芽して分離する現象が細胞自身にも存在するかは不明でした。
末次教授のグループは、細胞膜の形態を制御する Bin-Amphiphysin-Rvs(BAR)ドメイン(注 3)と呼ばれるタンパク質モジュール(機能的な構成単位)の研究を進めてきました。特に、I-BAR ドメインは細胞膜を外向きに湾曲させて突起を形成する性質を持ちます。これまで細胞突起は主に細胞移動に関わる構造と考えられていましたが、情報伝達の役割は知られていませんでした。
2021 年に末次教授と同研究室の西村准教授らは、I-BAR ドメインを持つタンパク質 MIM が脂質膜の小胞形成を誘導すること、さらに MIM 依存的に形成される突起が切断されて細胞外小胞となり、その小胞を別の細胞に与えると細胞運動が促進されることを発見しました(*1)(図 1)。この際、 Rac1 タンパク質(注 4)が EV を介して運ばれ、受容細胞で機能することを明らかにしていました。
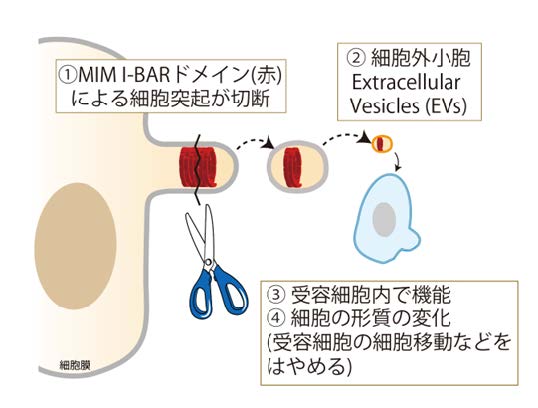
【研究の内容】
今回の研究では、I-BAR ドメインタンパク質 MIM によって形成される突起由来 EV を詳細に解析し、以下の成果を得ました。
1) 突起由来 EV は、Rac1 を効率的に送達し細胞運動を促進する。
Rac1 を搭載した突起由来 EV は、受容細胞に取り込まれた後、エンドソームを経由して細胞質に放出され、細胞移動を誘導しました。生化学的解析により、その送達量を決定しました。その結果、ガラス細管などで直接注入する「顕微注入法(マイクロインジェクション)」によって送達される送達量と同等レベルであることが示されました(図 2)。この取り込み過程は、エンドサイトーシスにより取り込まれ、のちにエンドソームから放出される過程を経ることが、岐阜大学の鈴木教授らとの共同研究により、超解像顕微鏡観察で可視化されました(図 3)。
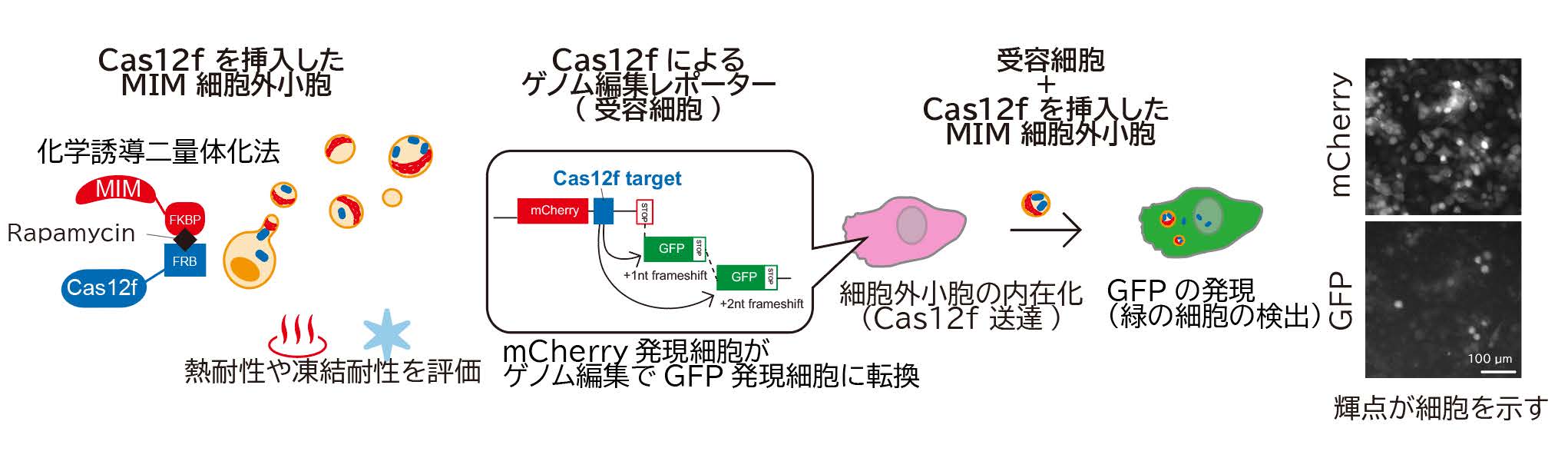
2) 突起由来 EV は、遺伝子編集酵素 Cas12f を効率的に送達できる。
東京大学の濡木教授が開発したゲノム編集酵素 Cas12f を、ジョンズ・ホプキンス大学の井上教授らの分子会合制御技術を用いて MIM タンパク質に連結し、突起由来 EV に搭載しました(図 4)。その結果、エンドソーム由来 EV(CD63 依存型)よりも高効率に酵素を送達し、受容細胞において高い遺伝子編集効率を示しました。
3) 突起由来 EV は熱や凍結に対して安定である。
加熱や凍結後も、Rac1 および Cas12f が機能を保持していることが確認されました。
また、研究の主たる部分は、科学技術振興機構(JST)戦略的創造研究推進事業 CREST「細胞膜の自在造形による生体物資の万能送達」(研究代表者 末次教授、研究分担者 鈴木教授、井上教授、アドバイザー 濡木教授)の支援により行われました。
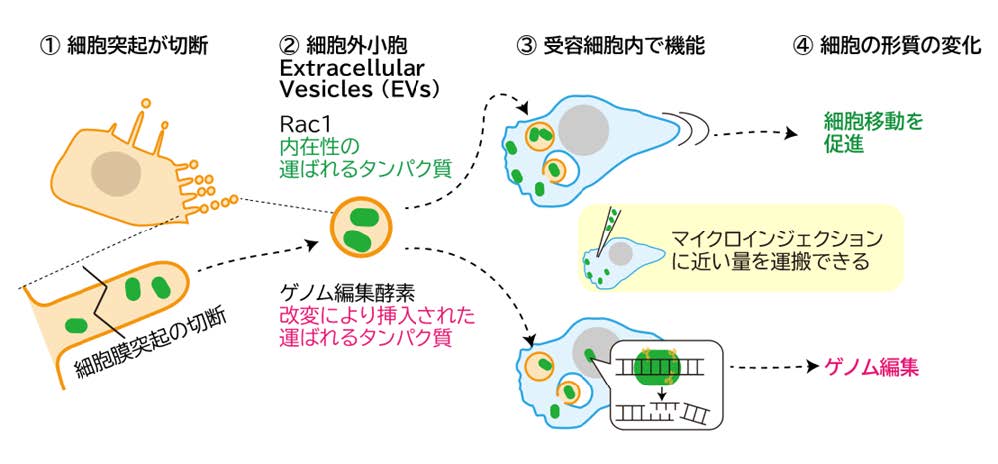

図 2 の③の放出過程を可視化したと思われる超解像観察(奈良先端大で実施)。
【今後の展開】
本研究により、ウイルスを使用せずに細胞内へ機能性タンパク質を届ける新しい天然ナノキャリアとしての突起由来 EV の可能性が示されました。再生医療、免疫療法、がん治療、さらには安全な遺伝子編集技術の開発や DDS キャリアとしての利用など、多様な応用が期待されます。そのためには、標的細胞の特異性の分子機構とその制御、受容細胞での送達タンパク質の動態(エンドソームからの放出機構など)の具体的な解明、内在性のタンパク質の EV への挿入機能の理解などのさらなる研究の進展が求められます。
さらに、この仕組みは内在性の伝達機構に立脚すること、これまで分泌されないと考えられていた細胞質タンパク質が細胞間で送達されうることなどを明らかにした本研究の成果は、多細胞生物における細胞間コミュニケーションの新しい概念を提示します。
【謝辞】
本研究は、JST 戦略的創造研究推進事業 CREST(JPMJCR24B3)、科学研究費補助金(基盤研究(B)
(JP24K02024、JP23H02476、JP20H03252)、基盤研究(C)(JP24K09778、JP20K06625、JP17K07427)、
基盤研究(S)(JP21H05047)、国際共同研究強化(A)(JP20KK0341)、学術変革領域研究(A)(JP24H01286))、
JST 創発的研究支援事業(JPMJFR2413)、武田科学振興財団などの支援を受けて行われました。
【用語解説】
注 1 細胞突起(フィロポディア)
糸状仮足とも呼ばれ、運動性が高く、細長い細胞表面の突起構造。
注 2 脂質膜
生体膜は脂質膜から構成され、脂質膜を構成する脂質は、水になじむ親水性部分と水になじまない疎水性の部分からなる両親媒性脂質である。水溶液中では水になじまない疎水性の部分が水中で向き合い、水になじむ親水性の部分が水溶液に面している。生体膜を構成する両親媒性脂質として代表的なものに、フォスファチジルセリン、フォスファチジルコリン、フォスファチジルエタノールアミンなどがある。
注 3 Bin-Amphiphysin-Rvs(BAR)ドメイン
カーブ構造をしており、脂質膜に結合することで、タンパク質の形を鋳型として小胞を含む脂質膜の形態を形成する。このように生体膜の形を制御するタンパク質としては、ほぼ唯一知られているタンパク質である。BAR ドメインは、BAR、F-BAR、I-BAR の 3 種に大別される。この中で、I-BAR ドメインは主に細胞突起形成に関与すること、F-BAR ドメインおよび BAR ドメインは、主にエンドサイトーシスに関与することがわかっていた。
注 4 Rac1 タンパク質
Rac1(RAS-related C3 botulinus toxin substrate 1)は、低分子量 G タンパク質と呼ばれる分子スイッチである。Rac1 は、細胞内のアクチン細胞骨格を制御することで細胞の形態を制御する。細胞の形態が、徐々に遷移することで細胞を移動する。このため、Rac1 は、がん細胞などの細胞移動(つまり転移)や免疫細胞の貪食反応(異物に向かって移動)、および神経細胞の軸索新調などを制御すると考えられている。
【引用文献】
*1 Nishimura T. et al., Developmental Cell(2021), DOI:10.1016/j.devcel.2021.02.029
【掲載論文】
タイトル:Efficient Cellular Transformation via Protein Delivery through the Protrusion-Derived Extracellular Vesicles
(細胞突起由来細胞外小胞を介したタンパク質送達による効率的な細胞形質転換)
著者:藤岡敏史¹、西村珠子¹,*、川名裕己¹、廣澤幸一朗²、山川怜太¹、ハニ・サピリ¹、矢倉加代子¹、中川綾哉³、井上尊生⁴⁵、濡木理³、鈴木健一²⁶、末次志郎¹⁴⁵⁷⁸⁹,*
所属:
¹ 奈良先端科学技術大学院大学 先端科学技術研究科 バイオサイエンス領域(奈良県生駒市)
² 岐阜大学 糖鎖生命コア研究所(iGCORE)(岐阜県岐阜市)
³ 東京大学 大学院理学系研究科 生物科学専攻(東京都文京区)
⁴ ジョンズ・ホプキンス大学 医学部 生体医工学科(米国メリーランド州ボルチモア)
⁵ ジョンズ・ホプキンス大学 医学部 細胞動態センター/細胞生物学科(米国メリーランド州ボルチモア)
⁶ 国立がん研究センター研究所 先端バイオイメージング分野(東京都中央区)
⁷ 奈良先端科学技術大学院大学 データ駆動型サイエンス創造センター(奈良県生駒市)
⁸ 奈良先端科学技術大学院大学 先端科学技術研究科附属デジタルグリーンイノベーションセンター(奈良県生駒市)
⁹ 奈良先端科学技術大学院大学 先端科学技術研究科附属メディルクス研究センター(奈良県生駒市)
*責任著者
掲載誌:Nature Communications
DOI:10.1038/s41467-025-66351-1
【分子医学細胞生物学研究室】
研究室紹介ページ:https://bsw3.naist.jp/courses/courses210.html
研究室ホームページ:https://bsw3.naist.jp/suetsugu/
(2025年12月09日掲載)
 奈良先端科学技術大学院大学
奈良先端科学技術大学院大学