生命維持のために細胞社会の秩序を守る新たな仕組みを解明
不要な細胞を排除する“力”と“カルシウム”の濃度上昇が連携プレーしていた
~細胞の「死」をきっかけに生まれる力学的カルシウム波の仕組みを発見~
生命維持のために細胞社会の秩序を守る新たな仕組みを解明
不要な細胞を排除する“力”と“カルシウム”の濃度上昇が連携プレーしていた
~細胞の「死」をきっかけに生まれる力学的カルシウム波の仕組みを発見~
【概要】
奈良先端科学技術大学院大学(学長:塩﨑一裕)先端科学技術研究科 バイオサイエンス領域の松井貴輝准教授(生命科学研究基盤センター、メディルクス研究センター)、別所康全教授(生命科学研究基盤センター)、物質創成科学領域の山田壮平特任助教(現:弘前大学大学院理工学研究科・助教)、安國良平助教(現:大阪工業大学工学部・准教授)、細川陽一郎教授(メディルクス研究センター)、および、京都大学医学研究科の藤田恭之教授による共同研究グループは、細胞が互いに力を伝え合いながら不要な細胞を排除して秩序を保つ新しい仕組みを発見しました。
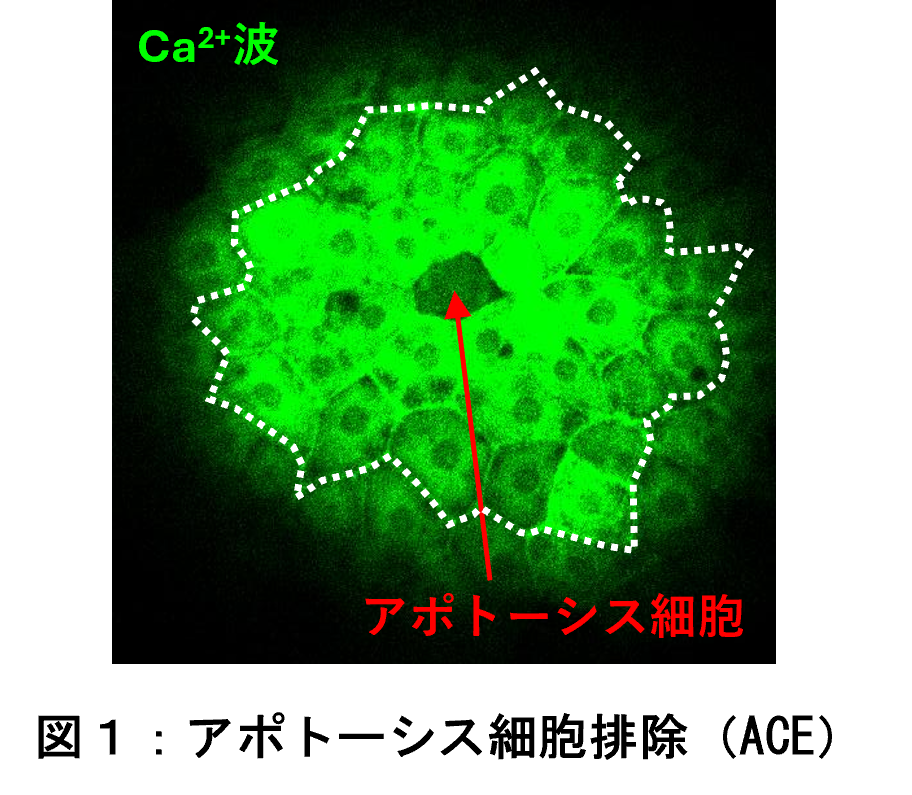
私たちの体の表面を覆う上皮組織では、古くなったり傷ついたりした細胞が自ら死んで取り除かれることで、組織の健全な状態が維持されています。このアポトーシス(注 1)という現象により、死細胞が押し出されて除去される過程は「アポトーシス細胞排除(ACE; apoptotic cell extrusion)」と呼ばれています。本研究では、この ACE の過程で、カルシウムイオン(Ca²⁺)の一時的な濃度上昇に伴うカルシウム波(注 2)が細胞間を伝わり、細胞集団の協調的な動きを促すことで細胞が排除されることを明らかにしました。
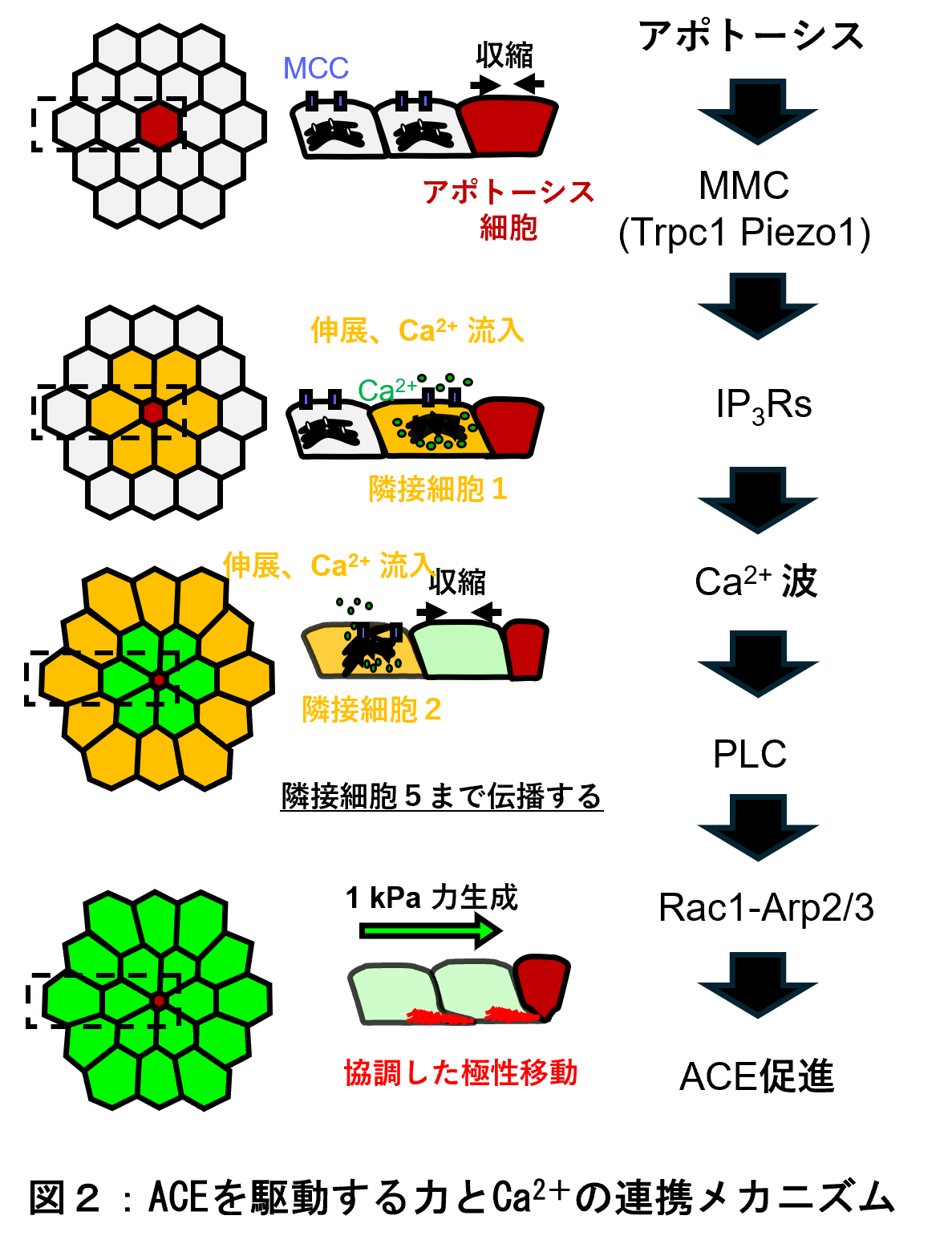
従来、カルシウム波の伝達には隣接する細胞同士を直接つないで分子の通り道を作る「ギャップ結合」(注 3)が不可欠と考えられてきましたが、本研究グループは、ギャップ結合がなくてもカルシウム波が隣接する細胞へと伝わることを発見しました。さらに詳細な解析により、このカルシウム波の伝播は、細胞の「力」を介した連鎖反応によって起こることを明らかにしました。すなわち、死にゆく細胞が収縮して周囲の細胞を物理的に引っ張ると、その機械的な刺激によって隣接細胞の膜上にある「機械感受性カルシウムチャネル(MCC;mechanosensitive Ca²⁺ channel)」(注 4)が開き、カルシウムが細胞内に流入します。この反応が連続的に起こることで、波のようにカルシウムシグナルが組織全体に伝わっていくのです。
さらに、このカルシウム波は、周囲の細胞群の動きを方向づけ、細胞集団が協調して死んだ細胞を押し出すように動くことを促すことも確認しました。その際、細胞群は、1 平方センチ当たり 10 グラムの力に相当する「約 1 キロパスカル(1kPa)の力」を発生させており、細胞社会の秩序を維持するための「力とカルシウムの連携プレー」が明らかになりました。
本研究成果は、Nature Communications 誌に 2025 年 11 月 17 日(月曜日)午後 7 時(日本時間)にオンライン掲載されます(DOI:10.1038/s41467-025-65474-9)。
【研究のポイント】
・従来のギャップ結合による伝達ではなく、力を介したメカノシグナル伝達によってカルシウム波が広がることを世界で初めて示しました。
・カルシウム波が、細胞集団の協調的な運動を制御する指令信号として機能することを明らかにしました。
・組織の恒常性維持の新しい原理を提示し、がんの浸潤や創傷治癒、再生医療などへの応用可能性を示しました。
【社会的意義】
本研究は、細胞が互いに力を伝え合いながら秩序を保つという、これまでにない概念を提示した成果です。この発見により、がん細胞の異常な浸潤や組織再生の制御など、力学とシグナル伝達の連携に基づく新しい医学生物学的研究の展開が期待されます。将来的には、細胞間の力学的情報伝達を制御することで、病態の進行を抑制したり、再生を促進したりするような新しい治療戦略の開発にもつながる可能性があります。
【背景と目的】
カルシウム(Ca²⁺)の波は、受精や胚発生、創傷治癒など、さまざまな生命現象において観察される、基本的な細胞間コミュニケーションの仕組みです。細胞内外でのカルシウムの出入りについては、電位依存性チャネルやメカノセンサーとして働く Piezo1 や TRP チャネルなど、複数のカルシウムチャネルが関与していることが知られています。一方、細胞間でのカルシウム波の伝達は、主にギャップ結合を介して行われると考えられてきました。
しかし、上皮組織では日常的に細胞死や損傷が起こり、これらの細胞を排除しながらもバリア機能を保つ必要があります。そのため、死んだ細胞を上皮の表面から押し出す「アポトーシス細胞排除
(ACE)」が働いています。近年、Piezo1 などの機械感受性チャネルがこの過程に関与することが示唆されていますが、カルシウム波がどのように機械的刺激を介して伝達されるのか、その詳細な分子メカニズムや生物学的意義は明らかになっていませんでした。
そこで本研究では、ゼブラフィッシュ胚の上皮組織をモデルとして ACE の過程を可視化し、機械感受性カルシウムチャネル(MCC)および小胞体のカルシウム放出機構(IP₃受容体)(注 5)を介して、細胞間カルシウム波がどのように伝達されるのかを明らかにすることを目的としました。
【研究の内容】
本研究グループは、ゼブラフィッシュ(注 6)胚の上皮組織をモデルに、アポトーシス細胞の排除過程を生きた状態で観察できるイメージングシステムを構築しました。フェムト秒レーザー(注 7)を用いて上皮組織内の単一細胞にアポトーシスを誘導し、その際に生じるカルシウムの流入をリアルタイムで解析した結果、アポトーシス細胞を起点として周囲の細胞へカルシウム波が伝わる現象を確認しました(図 1)。
ギャップ結合を阻害してもカルシウム波が伝達されることから、これまでとは異なる経路が関与していることが示唆されました。さらに解析を進めた結果、機械感受性カルシウムチャネル(MCC:Piezo1 および TRPC1)と小胞体のカルシウム放出受容体(IP₃R)が連鎖的に作動することで、カルシウム波が細胞から細胞へと伝わっていくことを明らかにしました。
このカルシウム波の伝搬は単なるシグナルではなく、周囲の細胞に Rac–Arp2/3 経路(注 8)を介した極性化と協調的な運動を引き起こし、死んだ細胞を押し出すための力(約 1kPa)を生み出すことがわかりました。つまり、細胞死をきっかけに「力」と「カルシウム」の連携による集団的運動が生じ、上皮組織の秩序を維持していることが明らかになりました(図 2)。
【今後の展開】
本研究は、細胞が力を介して情報を伝え合うという新しい細胞間コミュニケーションの仕組みを明らかにしたものです。このメカニズムは、正常な上皮組織の維持だけでなく、がんの浸潤や転移、創傷治癒、組織再生など、多くの生命現象に関わっている可能性があります。
今後は、異常な力学シグナルやカルシウム波伝達の破綻が、がんや老化関連疾患の発症・進展にどのように関与するかを解析していく予定です。さらに、機械刺激とカルシウム応答を制御する分子群を標的とした新しい治療法や再生医療への応用を目指します。
【用語解説】
注 1 アポトーシス(apoptosis):細胞が自らの意思で死ぬようにプログラムされた「細胞の自殺」のこと。細胞が不要になったり、損傷を受けたりしたときに、周囲に炎症を起こさずに安全に除去される仕組みであり、個体の発生や組織の維持に重要な役割を果たしている。
注 2 カルシウム(Ca²⁺)波:細胞内でカルシウムイオン(Ca²⁺)の濃度が一時的に上昇し、そのシグナルが隣接する細胞へと波のように伝わる現象である。受精、創傷治癒、細胞運動など、多様な生命現象に関与する細胞間コミュニケーションの基本的な仕組みである。
注 3 ギャップ結合(gap junction):隣り合う細胞同士をつなぐ微小なチャネル構造であり、イオンや小さな分子を直接やり取りできる。細胞間で電気的・化学的な情報を伝えるための主要な経路として知られている。
注 4 機械感受性カルシウムチャネル(mechanosensitive Ca²⁺ channel):細胞膜に存在し、外部からの「力」や「変形」を感知して開くタイプのカルシウムチャネルである。代表的なものに Piezo1 や TRP チャネルがあり、機械的刺激によって細胞内にカルシウムが流入し、細胞応答を引き起こす。
注 5 IP₃受容体(inositol 1,4,5-trisphosphate receptor):小胞体膜上に存在するカルシウム放出チャネルで、細胞内メッセンジャーであるイノシトール三リン酸(IP₃)によって活性化される。これにより小胞体内に蓄えられたカルシウムが細胞質へ放出され、シグナル伝達を制御する。
注 6 ゼブラフィッシュ(zebrafish):体が透明で発生過程を観察しやすいことから、発生生物学や再生医学などの研究で広く利用される小型魚類である。ヒトと多くの遺伝子を共有しており、病気モデル動物としても注目されている。
注 7 フェムト秒レーザー(femtosecond laser):1 フェムト秒(1 兆分の 1 の 1000 分の 1 秒=10⁻¹⁵秒)という極めて短い時間だけ光を発する超短パルスレーザーである。細胞や組織を精密に損傷させることができるため、生体内で特定の細胞にアポトーシスを誘導する研究などに利用される。
注 8 Rac–Arp2/3 経路:細胞の形や運動を制御する分子経路であり、Rac という小型 GTP 結合タンパク質が Arp2/3 複合体を活性化してアクチン線維の形成を促す。これにより、細胞が特定の方向に極性化し、集団として協調的に移動することが可能になる。
【掲載論文】
タイトル:Mechanochemical mechanism underlying intercellular Ca2+ wave propagation and its crucial role in apoptotic cell extrusion
著者:Sohei Yamada, Ryohei Yasukuni, Yasumasa Bessho, Yasuyuki Fujita, Yoichiroh Hosokawa,
Takaaki Matsui(責任著者)
掲載誌:Nature Communications
DOI:10.1038/s41467-025-65474-9
【遺伝子発現制御研究室】
https://bsw3.naist.jp/courses/courses308.html
https://sites.google.com/view/bessho-lab-top
(2025年11月19日掲載)
 奈良先端科学技術大学院大学
奈良先端科学技術大学院大学