分化・形態形成学講座の蘆田弘樹助教が、第57回日本生化学会近畿支部例会「優秀発表賞」を受賞しました
57回日本生化学会近畿支部例会「優秀発表賞」は、口頭発表とポスター発表の内容に対し、学会参加者からの投票により選出される賞です。
蘆田弘樹助教のコメント
 植物や藻類が営む光合成では、地球のCO2濃度をコントロールするほど大量の炭素を固定しています。この光合成CO2固定において、リブロースビスリン酸カルボキシラーゼ/オキシゲナーゼ (RuBisCO)は大気中のCO2を直接細胞内の有機物に固定する反応を触媒している、鍵となる酵素です。私たちは、生物が進化の過程でどのように光合成CO2固定ができるようになったのか、光合成を行わない細菌が持つ、RuBisCOの起源と考えられるRuBisCO-like proteinの解析を通して研究してきました。今回、最新の結果を加え、これまでの研究成果を総括して発表し、優秀賞を受賞することができました。これには、研究室のスタッフ、学生、共同研究者の方々、特に中心的に研究に従事してくれた齋藤洋太郎博士(現在は地球環境産業技術研究機構研究員)、中野寿宏博士(現在は本学GCOE PD)の御協力なしにはありえなかったことであり、深く感謝いたします。この受賞を励みに、より一層、生化学また光合成分野の発展に貢献させていただきたいと思います。
植物や藻類が営む光合成では、地球のCO2濃度をコントロールするほど大量の炭素を固定しています。この光合成CO2固定において、リブロースビスリン酸カルボキシラーゼ/オキシゲナーゼ (RuBisCO)は大気中のCO2を直接細胞内の有機物に固定する反応を触媒している、鍵となる酵素です。私たちは、生物が進化の過程でどのように光合成CO2固定ができるようになったのか、光合成を行わない細菌が持つ、RuBisCOの起源と考えられるRuBisCO-like proteinの解析を通して研究してきました。今回、最新の結果を加え、これまでの研究成果を総括して発表し、優秀賞を受賞することができました。これには、研究室のスタッフ、学生、共同研究者の方々、特に中心的に研究に従事してくれた齋藤洋太郎博士(現在は地球環境産業技術研究機構研究員)、中野寿宏博士(現在は本学GCOE PD)の御協力なしにはありえなかったことであり、深く感謝いたします。この受賞を励みに、より一層、生化学また光合成分野の発展に貢献させていただきたいと思います。
受賞内容
私たちはこれまでに、光合成CO2固定酵素RuBisCOと相同性を示すタンパク質、RuBisCO-like protein (RLP)を古細菌やバクテリアに発見し、このタンパク質がCO2固定とは全く異なるアミノ酸代謝でエノラーゼとして働いていることを明らかにしてきました。RLPを持つ細菌は、生物がRuBisCOを使ってCO2固定を行えるようになるよりもずっと前に、すでに地球上に存在していたという進化仮説から、RLPがRuBisCOの祖先タンパク質であると考えられています。RLPは、CO2固定反応を触媒する能力は全くありませんが、ルビスコの基質リブロースビスリン酸と良く似た構造の基質に対して、RuBisCOのCO2固定の初発反応であるエノール化反応のみを触媒します。今回、枯草菌のRLPの生化学的解析を介して、新たにRuBisCO誕生の謎を解く上で重要な事実を明らかにしました。
RLPはRuBisCO活性中心のリブロースビスリン酸のエノール化を触媒するアミノ酸残基を全て保存しており、これら残基への変異導入はRLPを完全に失活させました。また、大阪大学大学院工学研究科の松村浩由准教授との共同研究により、RLPの結晶構造を明らかにしました。その結果、RLPはRuBisCOと同様にホモダイマー間に触媒部位を形成しており、さらにルビスコの触媒残基の配置がルビスコと酷似していたことから、RLPはルビスコと同じ残基を同じように利用してエノラーゼ反応を触媒していることが明らかになりました。また、RuBisCOはエノール触媒残基中の201番リジンがCO2によってカルバミル化修飾されることで、はじめて触媒能を発揮できる活性化型となります。興味深いことに、RLPの触媒活性もCO2存在下で活性化されました。実際、RLPの立体構造においても、この残基がCO2によって修飾された活性化型を採っていました。なぜ、CO2固定に全く関与しないRLPがCO2による活性化を必要とするのかは分かりませんが、RuBisCOの酵素特性を保存していたのです。さらに驚くべきことに、RLPのエノラーゼ活性は、ルビスコのCO2付加後の反応中間体の構造類似体によって拮抗的に阻害されたことから、RLPの触媒部位がCO2固定反応の中間体と結合できることが分かりました。この反応中間体への親和性はルビスコのCO2固定能に必須であることから、RLPがRuBisCOへ分子進化する以前から、CO2固定を触媒するための潜在能力を有していたことを意味しています。このように、RLPは自身のアミノ酸代謝における機能には全く必要でないRuBisCOとしての能力を隠し持っていたのです。これらのことから、光合成という能力を生物進化の過程で獲得する際に、CO2固定酵素としての潜在能力を持つRLPがRuBisCOを作り出すための基盤として利用されたと予想されます。進化における酵素の機能獲得のしたたかさが覗われます。
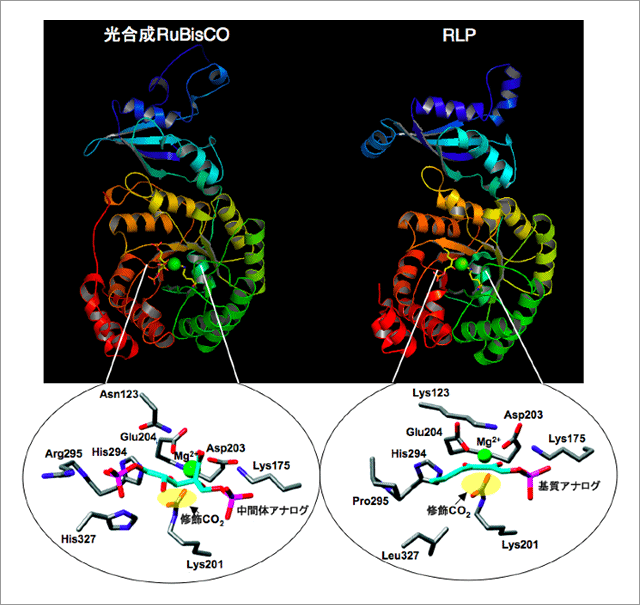
図 RLPと光合成RuBisCOの構造類似性
RLPとRuBisCOは全体構造が良く似ており、活性中心における触媒残基の立体配置も酷似している。触媒残基Lys201は、量酵素においてCO2によってカルバミル化修飾を受けている。図中の触媒残基は、反応に必須のマグネシウムイオンや基質結合に関与し、エノラーゼ反応におけるプロトン授受残基も含む。RuBisCOはLys201のCO2付加修飾によりはじめて触媒可能となるが、RLPにおいてもこの残基が同様の修飾を受けており、これはRLP触媒活性にも必要である。
関連する論文
- Crystal structure of the apo, decarbamylated form of 2,3-diketo-5-methylthiopentyl-1-phosphate enolase from Bacillus subtilis. Acta Crystallogr. D Biol. Crystallogr. 65 942–51 (2009)
- Structural and functional similarities between a RuBisCO-like protein from Bacillus subtilis and photosynthetic RuBisCO. J. Biol. Chem. 284 13256–13264 (2009)
- Crystallization and preliminary X-ray analysis of 2,3-diketo-5-methylthiopentyl-1-phosphate enolase from Bacillus subtilis. Acta Crystallographica Section F 65, 147–50 (2009)
- RuBisCO-like proteins as the enolase enzyme in the methionine salvage pathway: Functional and evolutionary relationships between RuBisCO-like proteins and photosynthetic RuBisCO. J. Exp. Bot. 59, 1543-54 (2008)
- A New Rubisco-like Protein Coexists with a Photosynthetic Rubisco in the Planktonic Cyanobacteria Microcystis. J. Biol. Chem. 281, 24462-24471 (2006)
- Was photosynthetic RuBisCO recruited by acquisitive evolution from RuBisCO-like proteins involved in sulfur metabolism? Res Microbiol. 156, 611-8 (2005)
- Bacterial variations on the methionine salvage pathway BMC Microbiology, 4, 9 (2004)
- A functional link between RuBisCO-like protein of Bacillus and photosynthetic RuBisCO. Science, 302, 286-290 (2003)
(2010年08月04日掲載)
 奈良先端科学技術大学院大学
奈良先端科学技術大学院大学