脳の幹細胞の老化メカニズム解明に成功
~細胞若返り誘導法の開発に期待~
脳の幹細胞の老化メカニズム解明に成功
~細胞若返り誘導法の開発に期待~
【概要】
バイオサイエンス領域脳神経機能再生学研究室の松田泰斗准教授、松田花菜江特任研究員らは、ヒトを含む哺乳類の脳内の海馬という記憶などを司る部位の神経幹細胞(注1)が加齢に伴い機能低下する現象は、遺伝子の働きを可逆的に調整するエピジェネティック修飾を制御する酵素「 Setd8 (注 2)」の働きの低下によって引き起こされることを明らかにしました。
さらに、海馬の神経幹細胞に対し、特異的に Setd8 の発現を抑制すると、神経幹細胞の枯渇が通常よりも早期に進行し、新生神経細胞の減少や記憶・学習機能の低下が引き起こされることを確認しました。
一方で、Setd8 の酵素活性を一時的に阻害すると神経幹細胞の機能は低下するものの、活性を回復させることで再び正常な機能を取り戻すことができることも明らかになりました。
この結果は、Setd8 の発現低下によるエピゲノム(注 3)および遺伝子発現の変化が可逆的であり、Setd8 の操作によって老化した神経幹細胞を「若返らせる」ことができる可能性を示唆しています。本研究の成果を基に、将来的には老化した細胞を再活性化する「若返りリプログラミング技術」の開発と加齢性疾患の克服が期待されます。
本研究成果は、国際学術誌「The EMBO Journal」に 2025 年 6 月 3 日(火)午後 7 時(日本時間) に公開されます(DOI:10.1038/s44318-025-00455-8)。
【背景と目的】
今回、本研究グループは、加齢に伴う神経幹細胞の機能変化の全貌を明らかにするため、最新の単一細胞解析技術を駆使して、神経幹細胞およびその分化系譜の遺伝子発現とエピゲノムの変化を時系列的に解析しました。その結果、成体マウスの海馬において、神経幹細胞が若年期からすでに老化に似た変化を始めており、その一因としてエピジェネティック因子「Setd8」の発現低下が関与していることを突き止めました。
私たちの脳には、記憶や学習などの高次機能を司る海馬と呼ばれる領域があり、そこには新たな神経細胞(ニューロン)を生み出す「神経幹細胞」が存在します。神経幹細胞は、加齢とともに数が減少し、働きも衰えることが知られており、その結果として記憶力や学習能力の低下が引き起こされると考えられています。しかし、こうした変化がどのような分子メカニズムによって引き起こされるのかは、十分に解明されていませんでした。特に、加齢により神経幹細胞の遺伝子発現がどのように変化し、それがエピゲノム制御(DNA メチル化やヒストン修飾など)とどのように連動しているかについては、多くの謎が残されていました。
そこで、本研究グループは、加齢に伴う神経幹細胞の機能変化の全貌解明と、将来的な「細胞の若返り」技術や加齢性疾患の新たな治療法の開発につなげることを目的として研究を開始しました。
【研究の内容】
本研究では、マウスの海馬に存在する神経幹細胞が加齢によりどのように変化するのかを明らかにするため、最先端の単一細胞解析技術(注 4)を用いました。具体的には、神経幹細胞とその分化系列にあたる前駆細胞や新生ニューロンを対象に、単一細胞遺伝子発現解析(scRNA-seq)および単一細胞クロマチン構造解析(scATAC-seq)を実施し、年齢によって生じるトランスクリプトームとエピゲノムの変化を時系列的に詳細に解析しました。
その結果、神経幹細胞は、若齢期(生後 5 日)から成熟期(生後 24 週)にかけて、幹細胞の性質は保持しつつも、徐々に加齢に伴う特徴を獲得していくことが明らかとなりました。特に、細胞の増殖に関わる遺伝子の発現低下や、炎症応答、インターフェロンシグナルといった老化関連の遺伝子の活性化が確認されました。
さらに、これらの加齢に伴う分子変化を引き起こす主要因として、DNA 分子を巻き取るヒストンタンパク質を化学的に修飾して構造を変化させる酵素「Setd8」の発現低下が関与していることを突き止めました。Setd8 は、ヒストン(H4)のアミノ酸配列で 20 番目のリジンに一重メチル化(H4K20me1、注 5)を施す唯一の酵素であり、その発現が低下すると、神経幹細胞におけるクロマチンの開閉状態(注6)が変化し、神経幹細胞の増殖能や神経分化能が著しく損なわれることが分かりました。
また、Setd8 の発現を一時的に抑制した場合には、神経幹細胞の機能低下が一過性であり、Setd8 活性の回復によって再び正常な機能を取り戻すことができることも確認されました。これは、神経幹細胞の老化が少なくとも一部は可逆的であることを示しており、将来的な細胞の「若返り」誘導への道を開く重要な知見となります。
【今後の展開】
本研究により、神経幹細胞の老化が特定のエピゲノム因子、Setd8 の発現低下によって引き起こされ、かつその老化現象が可逆的である可能性が示されました。これは、加齢によって機能を失った細胞に再び若々しい性質を取り戻させる“若返りリプログラミング”の実現に向けた大きな一歩です。
今後は、老化に伴って機能が低下する他の幹細胞や神経系細胞においても、Setd8 や関連するエピゲノム制御因子の役割を調べることで、老化に共通するメカニズムの解明が期待されます。また、Setd8 の活性を制御する化合物や遺伝子導入技術を応用することで、加齢による脳機能の低下や神経変性疾患(アルツハイマー病など)への新たな治療法の開発につながる可能性があります。
さらに、今回得られた神経幹細胞の老化に関する網羅的な単一細胞データセットは、今後の再生医療・老化研究における重要なリソースとして広く活用されることが期待されます。
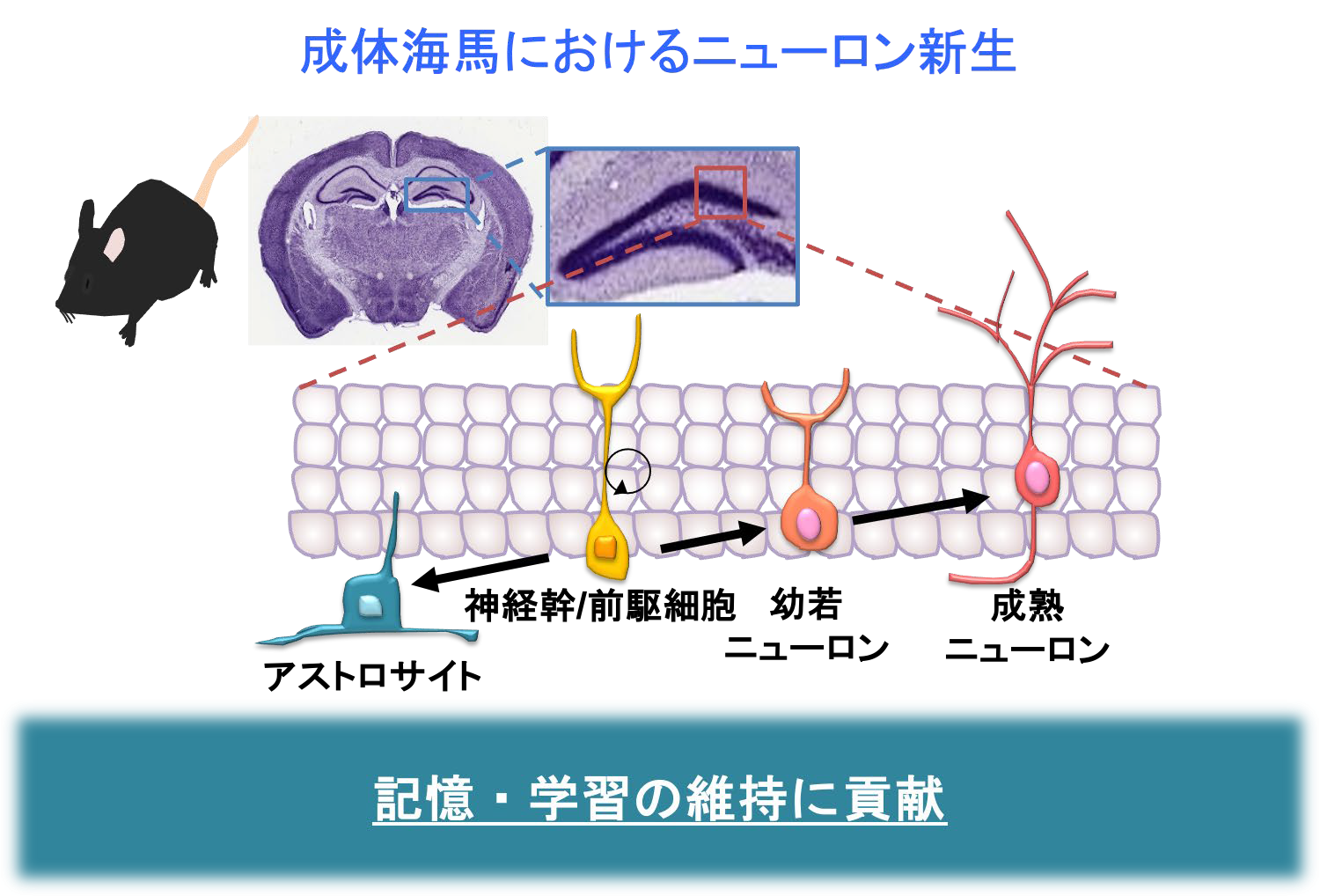
我々ヒトを含めて大人の脳の海馬と呼ばれる領域では、神経幹細胞からニューロンが産生されている。産生されたニューロンは海馬神経回路と接続することで、記憶・学習の維持に貢献している。
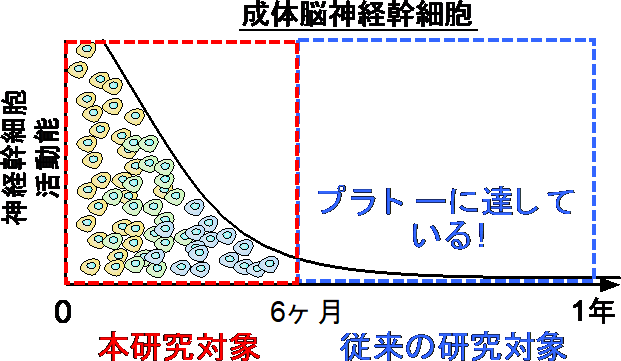
加齢に伴って、マウスの海馬神経幹細胞の増殖能、ニューロン産生能は急速に失われる(ヒトでも同様)。その結果、将来的な認知機能の低下につながるのではないかと考えられている。神経幹細胞機能低下は、アルツハイマー病による認知機能低下との関連も指摘されている。本研究では、従来研究では着目されてこなかった、加齢の初期段階のメカニズムを明らかにした。

単一細胞解析技術を駆使して、神経幹細胞およびその分化系譜の遺伝子発現(上図)とエピゲノムの変化(下図)を時系列的に解析した。その結果、成体マウスの海馬において、神経幹細胞が若年期からすでに老化に似た変化を始めていることを発見した。
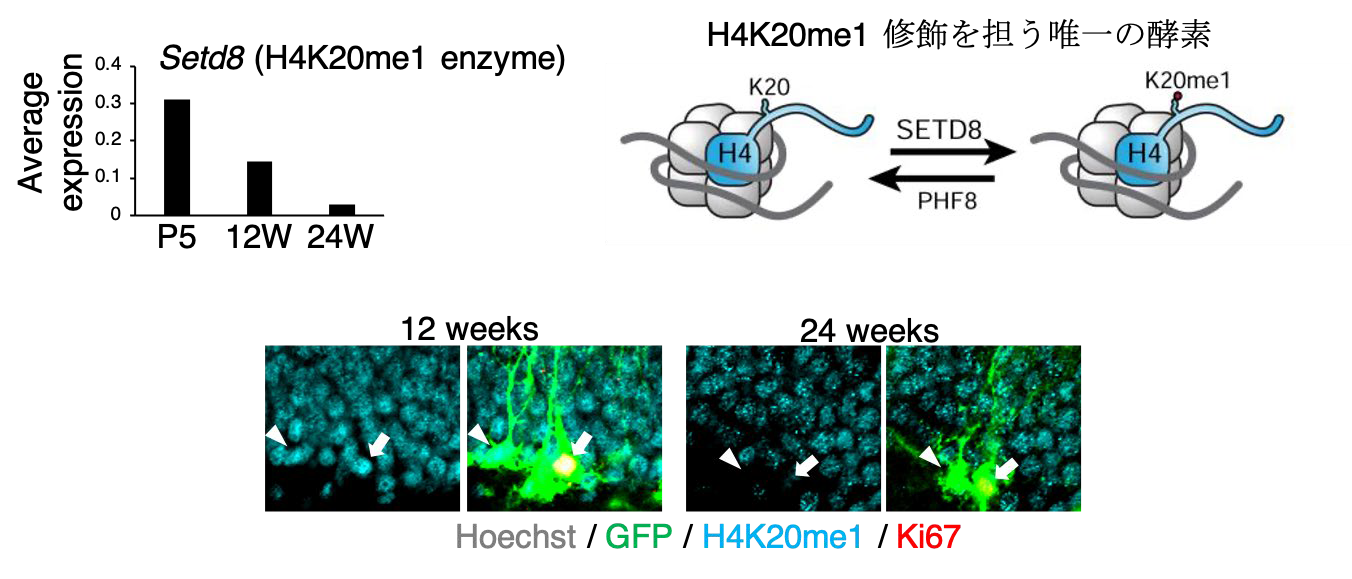
シングルセル解析データを用いて、加齢に伴って、マウスの海馬神経幹細胞においてSetd8 の発現が減少し、その結果H4K20me1 修飾レベルが低下することを見出した。
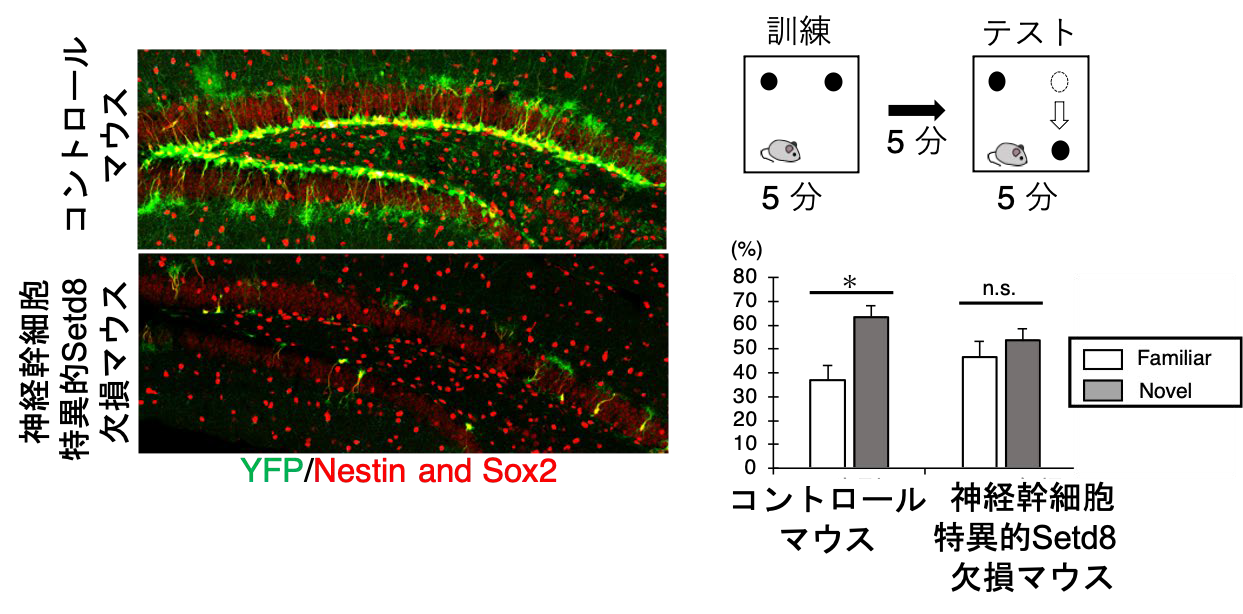
成体の神経幹細胞において特異的にSetd8 を欠損させたマウスでは、YFP陽性の神経幹細胞が減少(左図)、その結果ニューロン新生が低下することで、記憶学習障害が認められた (右図)。すなわち、若齢ステージにおいて、早期老化状態に陥ることを発見した。
【用語解説】
注 1 神経幹細胞:
脳内に存在し、新しい神経細胞(ニューロン)やグリア細胞(アストロサイト)を生み出すことができる幹細胞。特に海馬では、学習や記憶に関わる神経細胞を生み出す重要な役割を担っている。
注 2 Setd8:
ヒストン H4 の 20 番目のリジンに一重メチル化(H4K20me1)を施す酵素。この修飾は細胞の増殖や老化の制御に関与しており、Setd8 の発現低下は神経幹細胞の機能低下を引き起こす。
注 3 エピゲノム:
DNA そのものの配列を変えることなく、遺伝子の発現を制御する仕組みの総称。ヒストン修飾や DNA
メチル化などが含まれ、細胞の状態や機能を決定づける。
注 4 単一細胞解析:
個々の細胞ごとに遺伝子発現やエピゲノムの状態を解析する手法。細胞ごとの多様性や変化を精密に把握することができる。
注 5 H4K20me1:
ヒストン H4 タンパク質のリジン 20 番目に一重メチル化が加えられた修飾のこと。細胞周期制御や老化の進行に関与している。
注 6 クロマチンの開閉状態変化:
DNA がヒストンなどのタンパク質に巻きついている構造(クロマチン)が、開いていると遺伝子発現が ON の状態(あるいは今後 ON になる状態)、逆に閉じていると OFF の状態(あるいは今後 OFF になる状態)と考えられている。
~責任著者からの一言~
私たちの研究室では、細胞の運命を自在に変化させる「細胞リプログラミング」技術に注目し、これまでにも体細胞から神経細胞への直接的なリプログラミング法の開発に取り組んできました。その経験から、老化によって機能を失った細胞を“若返らせる”リプログラミングも実現可能であると考え、本研究に取り組みました。山中伸弥先生が iPS 細胞研究を開始された NAIST で、リプログラミング研究を推進できることを大変うれしく思っています。また、私自身が学生時代を過ごした場所で、新たに研究室を主宰できることに深い喜びと責任を感じています。本研究は第一著者の松原さんの学位論文です。実験を開始してから8年以上かけてようやく公開となりました。scRNA-seqおよびscATAC-seqのデータは7年前のものです。今後も、時間をかけることを恐れず、また、この人になら時間を預けてもいいと学生から思ってもらえるようなPIを目指したいです。
【掲載論文】
タイトル:Epigenetic Regulation of Neural Stem Cell Aging in the Mouse Hippocampus by Setd8 Downregulation
著者:Shuzo Matsubara, Kanae Matsuda-Ito, Haruka Sekiryu, Hiroyoshi Doi, Takumi Nakagawa,
Naoya Murao, Hisanobu Oda, Kinichi Nakashima, Taito Matsuda
掲 載 誌 :The EMBO journal DOI:10.1038/s44318-025-00455-8
【脳神経機能再生学研究室】
研究室紹介ページ:https://bsw3.naist.jp/courses/courses314.html
研究室ホームページ:https://bsw3.naist.jp/matsuda/
(2025年06月05日掲載)
 奈良先端科学技術大学院大学
奈良先端科学技術大学院大学