TGF-βシグナルが多様な生命現象を制御できる仕組みの一端を解明 ~転写因子SMAD2/3による補因子選択機構~
【発表者】
宮園 健一(東京大学大学院農学生命科学研究科 応用生命化学専攻 特任准教授)
森脇 沙帆(東京大学大学院農学生命科学研究科 応用生命化学専攻 修士課程2年;当時)
伊藤 友子(東京大学大学院農学生命科学研究科 応用生命化学専攻 特任研究員)
栗崎 晃(奈良先端科学技術大学院大学 バイオサイエンス研究科 教授)
浅島 誠(国立研究開発法人産業技術総合研究所 創薬基盤研究部門 名誉フェロー/創薬基盤研究部門招聘研究員)
田之倉 優(東京大学大学院農学生命科学研究科 応用生命化学専攻 特任教授)
【発表のポイント】
●TGF-βシグナル伝達系における主要な転写因子SMAD2/3と、その補因子の複合体構造の解析に成功しました。
● SMAD2/3が多様な補因子と相互作用する仕組みを明らかにしました。
●SMAD2/3と補因子の相互作用をターゲットとした創薬研究の発展が期待されます。
【発表概要】
TGF-βは、細胞の増殖や分化を制御する多機能性サイトカイン(注1)です。SMAD2/3はTGF-βシグナル伝達系における主要な転写因子であり、様々な補因子と結合することにより、多種多様な遺伝子発現の制御を行います。しかしながら、なぜSMAD2/3が様々な補因子と特異的に結合できるかについてはこれまでに明らかにされていませんでした。
今回、東京大学大学院農学生命科学研究科の田之倉優特任教授を中心とする奈良先端科学技術大学院大学、産業技術総合研究所の共同研究グループは、X線結晶構造解析法(注2)と様々な分析手法を組み合わせることにより、SMAD2/3による補因子選択機構を明らかにしました。SMAD2/3はその分子表面上に小さな疎水性領域(疎水性パッチ)を複数持ち、SMAD2/3の補因子はその疎水性パッチを結ぶように結合します。その疎水性パッチの組み合わせにより、多くの補因子がSMAD2/3に対し、競合的または共同的に結合することが考えられます。
TGF-βシグナル伝達系は、ガンや線維症といった重篤な疾病に関与しています。SMAD2/3による補因子選択機構を理解し、制御することが可能となれば、それらの疾病の新規治療薬の開発につながると期待されます。
栗崎 晃教授のコメント
幹細胞の分化制御は、詳しい分子メカニズムがよくわかっ ていないことが多く、まだまだ謎の多い研究分野です。幹細胞を分化制御する際に汎用されるアクチビンやBMPなどの細胞増殖分化因子はTGF-βスーパーファミリーに属しており、発生過程の様々な臓器、器官の分化を制御する多彩な作用を示すことが知られています。ところが、これらTGF-βスーパーファミリーメンバーは、細胞表面の受容体に結合した後、ほぼ共通の細胞内シグナル伝達経路を利用して下流の遺伝子の発現をコントロールします。これらの細胞外分泌因子の信号が、共通の細胞内シグナル伝達経路に集約されているのにもかかわらず、なぜこれらの因子が臓器、器官の各発生段階で多彩な分化作用を示すのか、あまりよくわかっていません。細胞分化のしくみを考える上で、その分子機構の謎を詳しく知りたいと思うのは私達だけではないと思いますが、今回の研究は、多くのTGF-βスーパーファミリーメンバーの細胞内シグナル伝達を制御する転写因子SMAD2/3が、他の転写因子とどのようなしくみで相互作用し、複雑なシグナルを制御するのか、構造学的な見地から明らかにしたものです。TGF-βのみならず、他のファミリー因子の分化制御作用を理解する上でも重要な発見だと思います。
ていないことが多く、まだまだ謎の多い研究分野です。幹細胞を分化制御する際に汎用されるアクチビンやBMPなどの細胞増殖分化因子はTGF-βスーパーファミリーに属しており、発生過程の様々な臓器、器官の分化を制御する多彩な作用を示すことが知られています。ところが、これらTGF-βスーパーファミリーメンバーは、細胞表面の受容体に結合した後、ほぼ共通の細胞内シグナル伝達経路を利用して下流の遺伝子の発現をコントロールします。これらの細胞外分泌因子の信号が、共通の細胞内シグナル伝達経路に集約されているのにもかかわらず、なぜこれらの因子が臓器、器官の各発生段階で多彩な分化作用を示すのか、あまりよくわかっていません。細胞分化のしくみを考える上で、その分子機構の謎を詳しく知りたいと思うのは私達だけではないと思いますが、今回の研究は、多くのTGF-βスーパーファミリーメンバーの細胞内シグナル伝達を制御する転写因子SMAD2/3が、他の転写因子とどのようなしくみで相互作用し、複雑なシグナルを制御するのか、構造学的な見地から明らかにしたものです。TGF-βのみならず、他のファミリー因子の分化制御作用を理解する上でも重要な発見だと思います。
【発表内容】
トランスフォーミンググロースファクターβ(TGF-β)は、細胞の増殖及び分化を制御する多機能性サイトカインであり、ガンや線維症といった重篤な疾病の発症にも関与しています。このTGF-βのシグナルは、細胞表層において、SMADと呼ばれる転写因子群のリン酸化へと変換されます。非常に高い保存性を持つ二つのタンパク質SMAD2及びSMAD3(SMAD2/3)は、TGF-βシグナル伝達系における主要転写因子の一つであり、シグナル依存的にリン酸化を受け、様々な遺伝子発現の制御を行います。多くの場合、SMAD2/3は他の補因子と高次の転写因子複合体を形成し作用することが知られています。TGF-βシグナルの多機能性は、この補因子の多様性と深く関係していますが、なぜSMAD2/3が、共通する特徴を持たない多くの補因子と特異的に結合できるかに関しては、ほとんど明らかにされていませんでした。そこで本研究グループは、SMAD2/3による補因子選択機構を構造学的な手法により明らかにしようと試みました。
SMAD2/3による補因子選択機構を明らかにするため、SMAD3と転写因子FOXH1の複合体、及びSMAD2と転写共抑制因子SKIの複合体の調製と、その構造学的な解析を行いました。それぞれの複合体結晶を作製し、大型放射光施設(注3)Photon Factoryのタンパク質結晶構造解析用ビームラインAR-NE3AにてX線回折データの取得を行いました。得られたX線回折データを用いてSMAD3とFOXH1の複合体構造、及びSMAD2とSKIの複合体構造を決定したところ(図1)、SMAD2/3の分子表面上には、疎水性のパッチが複数存在することが明らかになりました。FOXH1やSKIを含むSMAD2/3の補因子は、これらの疎水性パッチをつなぐような形でSMAD2/3に対し結合します(図2)。また、これらの疎水性パッチをより多くつなぐような人工タンパク質を設計し、表面プラズモン共鳴法(注4)や細胞を使ったアッセイによりその作用を解析したところ、より多くの疎水性パッチをつなぐ人工タンパク質は、SMAD2/3に対しより強く結合することが明らかになりました。この結果は、これらの疎水性パッチは互いに独立しており、疎水性パッチの組み合わせによって、SMAD2/3に対する結合力を変化させることができることを示しています。SMAD2/3に対して結合する補因子は、この疎水性パッチの組み合わせを変えることにより、多様な様式でSMAD2/3に対して特異的に相互作用すると考えられます。
今回の研究では、SMAD2/3が多くの補因子と結合することができることを示す構造基盤を明らかにすることができました。SMAD2/3の各補因子は、この疎水性パッチの組み合わせをうまく利用することにより、SMAD2/3に対し競合的もしくは共同的に結合すると考えられます。SMAD2/3とその補因子が形成する転写因子複合体は、TGF-βシグナル依存的な数多くの遺伝子発現の制御を行っていることが知られており、そのいくつかはガンや線維症といった重篤な疾病に関与しています。そのため、SMAD2/3と特定の補因子の相互作用を阻害することができる分子を、今回明らかにした構造情報を基に作製することができれば、これらの疾病に対する有効な治療薬となると期待されます。そのため本研究は、TGF-βシグナル伝達系の理解を深めるだけでなく、その制御を目指す創薬研究を進める上でも、非常に重要な成果であると言えます。
本研究は、文部科学省「創薬等支援技術プラットフォーム事業」及び、日本学術振興会科学研究費助成事業の支援を受けて行われました。
【発表雑誌】
雑誌名:「Science Signaling」(オンライン版:3月27日)
論文タイトル:Hydrophobic patches on SMAD2 and SMAD3 determine selective binding to cofactors
著者:Ken-ichi Miyazono, Saho Moriwaki, Tomoko Ito, Akira Kurisaki, Makoto Asashima, and Masaru Tanokura*
【用語解説】
(注1)サイトカイン
細胞から分泌されるタンパク質で、細胞間相互作用を媒介する生理活性物質の総称です。標的細胞にシグナルを伝達し、細胞の増殖・分化、細胞死、免疫、炎症反応の制御等、様々な機能を示します。
(注2)X線結晶構造解析法
生体高分子の結晶を作製し、そこにX線を照射すると、その結晶に特徴的な回折像が得られます。この回折像は、結晶を形成する分子の構造情報と相関があるので、そのパターンや強度を解析することによって、目的分子の三次元構造を決定することができます。
(注3)大型放射光施設
生体高分子の立体構造解析の精度は、構造解析の際に用いるX線回折データの品質(分解能)に大きく依存します。正確な立体構造を決定するためには、高品質なX線を利用できる大型放射高施設の利用が欠かせません。
(注4)表面プラズモン共鳴法
分子間の相互作用を測定する手法の一種です。解析したいサンプルをセンサーチップ上に固定し、その表面に相互作用する分子を作用させます。複合体形成に伴う分子の質量変化を観測することにより、分子間の相互作用を定量解析できます。
【解説図】
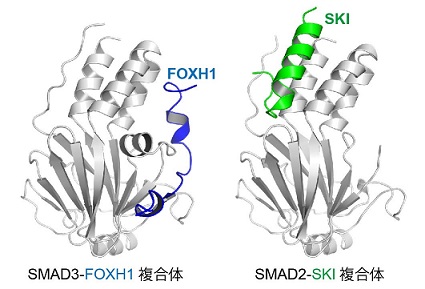
図1 X線結晶構造解析法により決定したSMAD3-FOXH1複合体構造及びSMAD2-SKI複合体構造
SMAD2/3は様々な結合面を使い、その補因子(FOXH1、SKI等)と相互作用します。
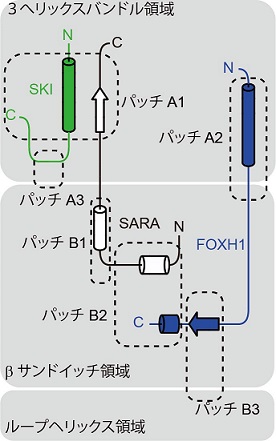
図2 SMAD2/3による補因子の結合
SMAD2/3の各補因子は、SMAD2/3分子表面(3へリックスバンドル領域、βサンドイッチ領域、ループヘリックス領域)上に存在する疎水性パッチ(パッチA1-A3及びB1-B3)をつなぐ形で、SMAD2/3に対し結合すると考えられます。SKIおよびFOXH1:今回の構造学的解析により明らかになったSMAD2/3と補因子の結合様式。SARA:構造情報が既知であったSMAD2/3と補因子の結合様式。各補因子は、いくつかのパッチを結ぶ形でSMAD2/3と結合します。
研究室紹介ページ: http://bsw3.naist.jp/courses/courses215.html
研究室ホームページ:http://bsw3.naist.jp/kurisaki/
(2018年04月06日掲載)
 奈良先端科学技術大学院大学
奈良先端科学技術大学院大学