神経システム生物学 (稲垣研究室)
-
研究室ホームページ
- https://bsw3.naist.jp/inagaki/
-
全学オンラインセミナー
2022年度に開催されたBio Discovery Session(全学オンラインセミナー)のアーカイブ動画の一覧です。 - Bio Discovery Session
-
Webメディア
NAIST Edge BIOは、奈良先端科学技術大学院大学 バイオサイエンス領域 の各研究室で取り組んでいる「最先端」の研究プロジェクトや研究成果について、研究者だけではなく受験生や一般の方にも分かりやすく紹介するためのWebメディアです。 - NAIST Edge BIO 第11回
研究・教育の概要
私たちの研究室では、最先端のバイオサイエンスの研究を通じて、優れた研究者および社会で活躍するリーダーを育成することを目指しています。そのためにも、毎週行われるミーティングで成果の発表と議論を行い、短期・長期の目標設定とスケジュールのマネージメントができるように指導をしています。また、留学生を交えた環境の中、異なるバックグラウンドを持った人と理解・協力し合えるグローバルな人材を育成します。研究室では、細胞生物学、生化学、分子生物学、発生生物学、生物物理学の最先端の手法を駆使して研究がおこなわれていますが、スタートは難しくはありません。まずは生化学・分子生物学の基礎を取得し、興味やプロジェクトに応じて様々な手技を学ぶことができます。また、日々の研究を通じて、基礎医学の知識やバックグラウンドも身につけることができます。ラット、マウス、ゼブラフィッシュ、培養細胞の扱いも身につきます。
主な研究テーマ
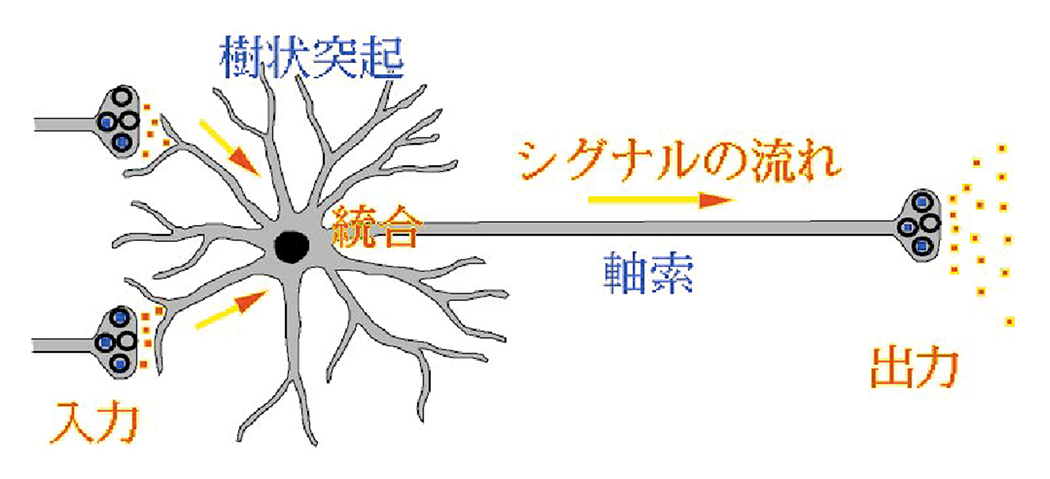
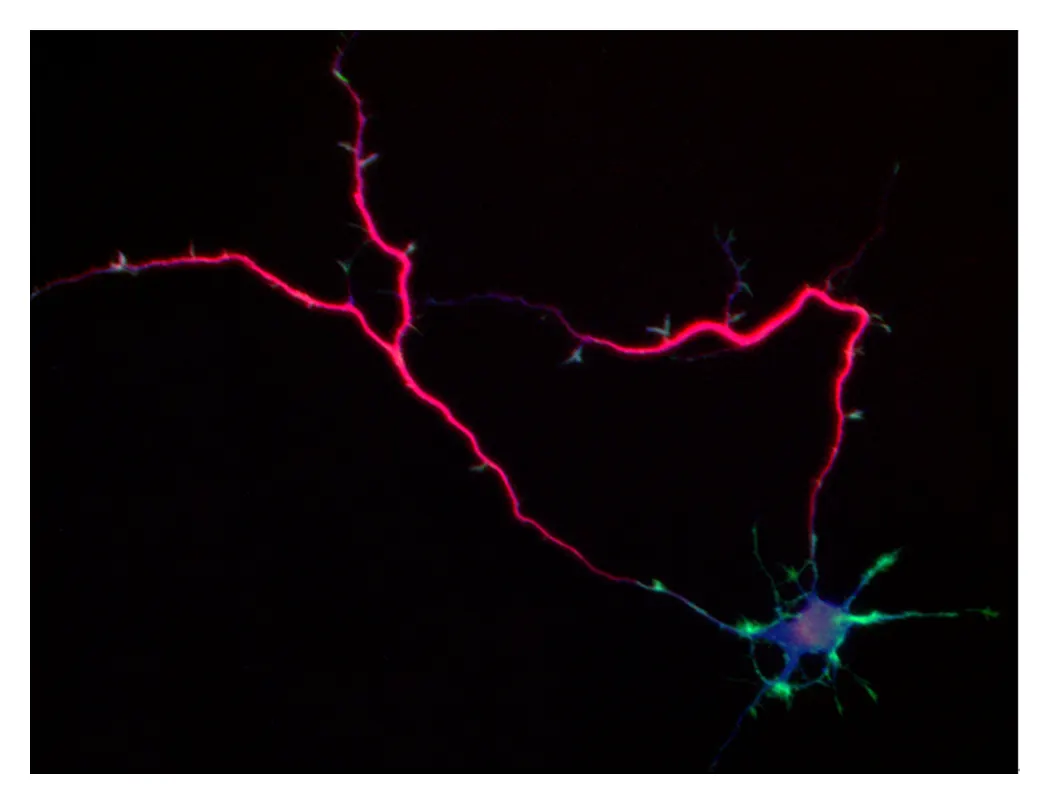
脳内の神経ネットワーク形成のしくみ
細胞が正しい場所へ移動するためのナビゲーションのしくみ
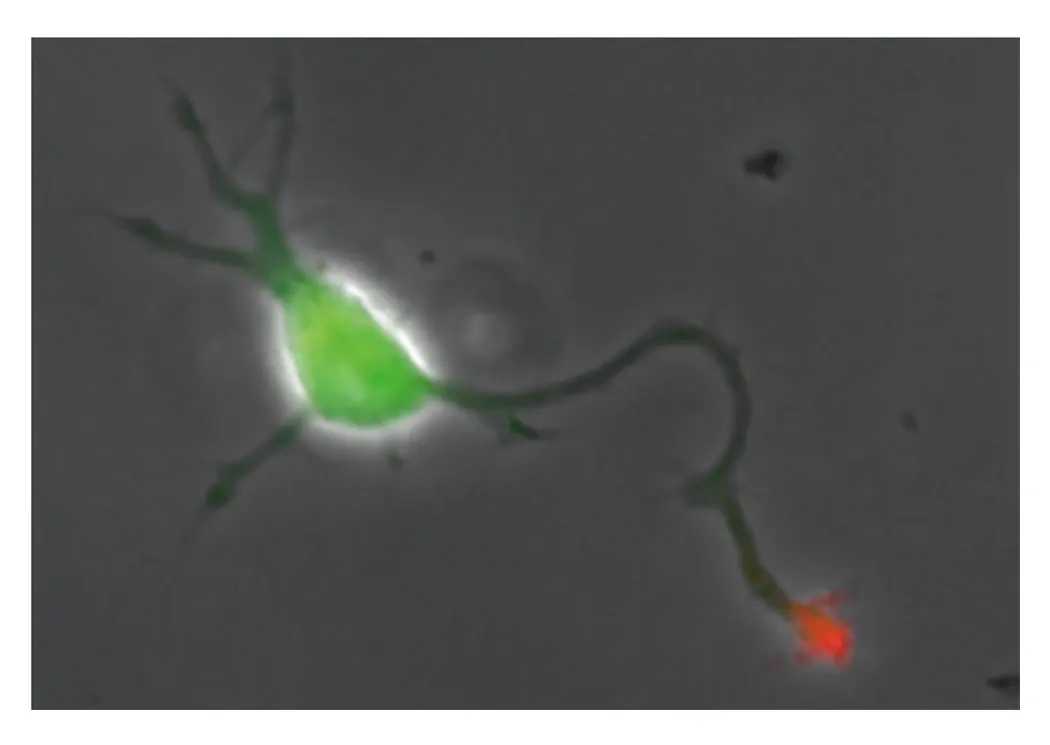
私たちの体の中では、細胞が、細胞外のシグナルを受け取って正しく移動することにより、個体発生や神経ネットワーク形成、免疫・生体防御、組織再生といった様々な生命機能を支えています。また、この仕組みに破綻が起こると、奇形やがんの転移、免疫不全といった病気になります。研究室では、様々な細胞が細胞外のシグナルを受け取ってどのようにして推進力を生み出し、正しい方向に移動することができるのか、そのナビゲーションの仕組みを分子レベルで解析しています(図3)。
医学への貢献を目指した研究
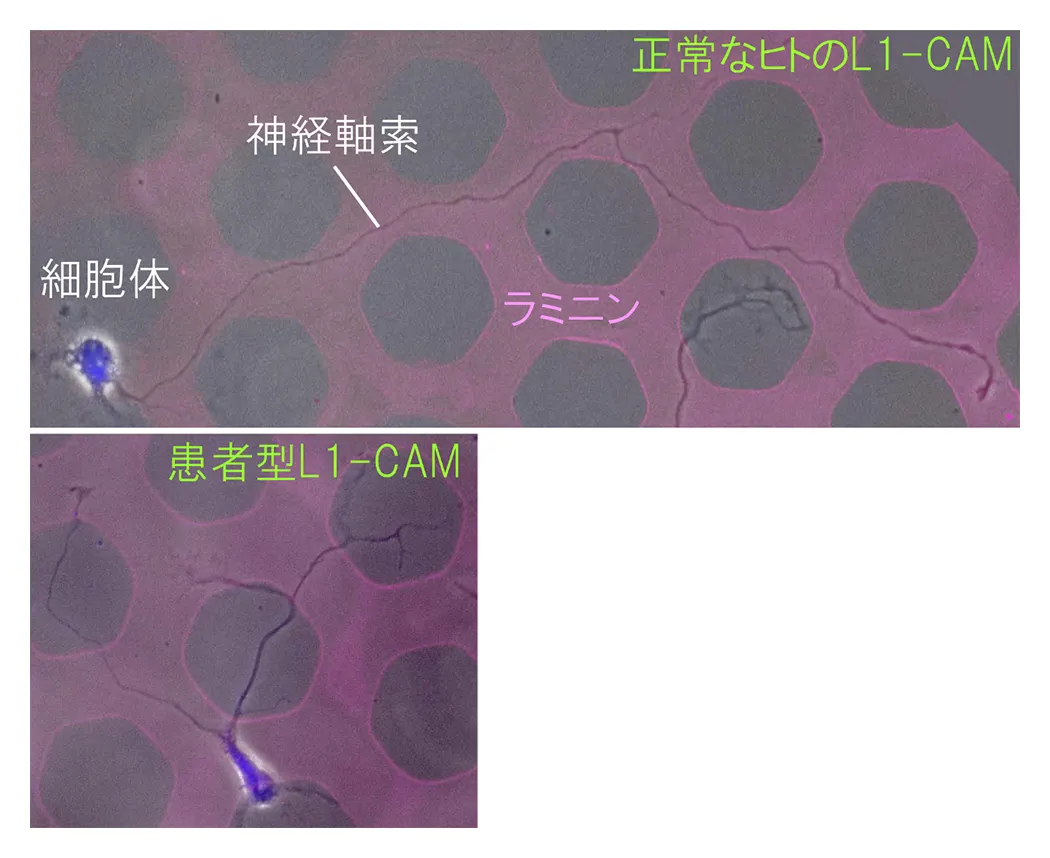
さらに、以上の基礎的な研究を基盤として、小児の神経難病の分子病態(図4)やがん細胞の浸潤転移の仕組みも解析しており、この様な研究を通じて医学への貢献を目指しています。また、これらに関連して、細胞内タンパク質輸送のしくみや記憶・学習の仕組み等も日々研究しています。
主な発表論文・著作
- Baba, K. et al., Adv. Sci., e02074, 2025
- Minegishi, T. et al., EMBO J., 44, 767-780, 2025
- Qiu, Z. et al, Front. Mol. Neurosci., 17, 1307755, 2024
- Kastian, R.F. et al., J. Biol. Chem., 299, 104687, 2023
- Minegishi, T. et al., Sem. Cell Dev. Biol., 140, 82-89, 2023
- Kastian, R.F. et al., Cell Reports, 35, 109130, 2021
- Abe, K. et al., Biophys. J., 120, 3566-3576, 2021
- Minegishi, T. et al., Cell Reports, 25, 624-639, 2018
- Abe, K. et al., Proc. Natl, Acad. Sci. USA, 115, 2764-2769, 2018
- Baba, K. et al., eLife, 7, e34593, 2018
- Inagaki, N., and Katsuno, H., Trends. Cell Biol. 27, 515-526, 2017
- Katsuno H. et al., Cell Reports 12, 648-660, 2015
- Kubo Y. et al., J. Cell Biol. 210, 663-676, 2015
- Toriyama M. et al., Curr. Biol., 23, 529-534, 2013
- Nakazawa H. et al., J. Neurosci., 32, 12712-12725, 2012
- Toriyama M. et al., Mol. Syst. Biol., 6, 394, 2010
- Shimada T. et al., J. Cell Biol., 181, 817-829, 2008
- Toriyama M. et al., J. Cell Biol., 175, 147-157, 2006
(こちらのリンクはすべて外部サイトへ遷移します![]() )
)
 奈良先端科学技術大学院大学
奈良先端科学技術大学院大学