研究テーマ
酵母のストレス耐性機構の解明と産業酵母の育種への応用
高等生物のモデル生物として、また発酵食品・バイオエタノール等の製造に重要な酵母を用い、様々な環境ストレスに対する細胞の新しい応答・適応・耐性機構を分子レベルで解明するとともに、産業酵母の高機能開発や創薬などへの応用を目指した研究を進めています。詳しくは、こちらをご覧ください。
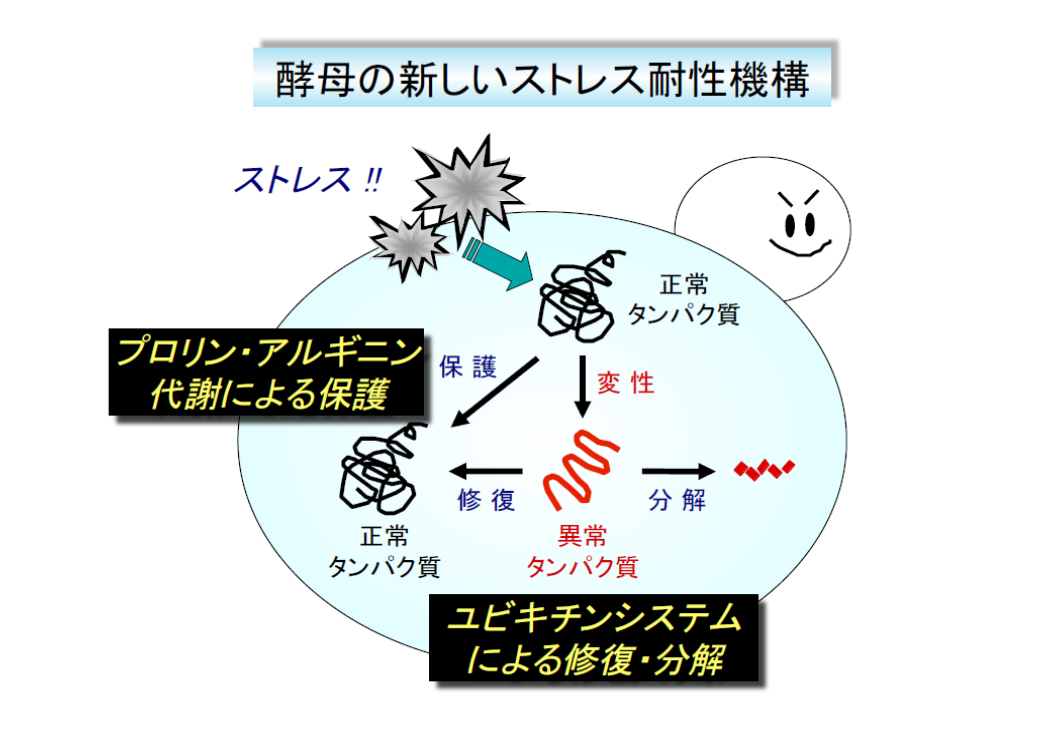
- プロリン・アルギニン代謝を介したストレス耐性機構
1) プロリンの代謝制御機構と生理的役割
2) N-アセチルトランスフェラーゼMpr1の分子機能(プロリンからのアルギニン合成)
3) 一酸化窒素(NO)の合成制御機構と生理的役割 - ユビキチンシステムによる異常タンパク質の修復・分解機構
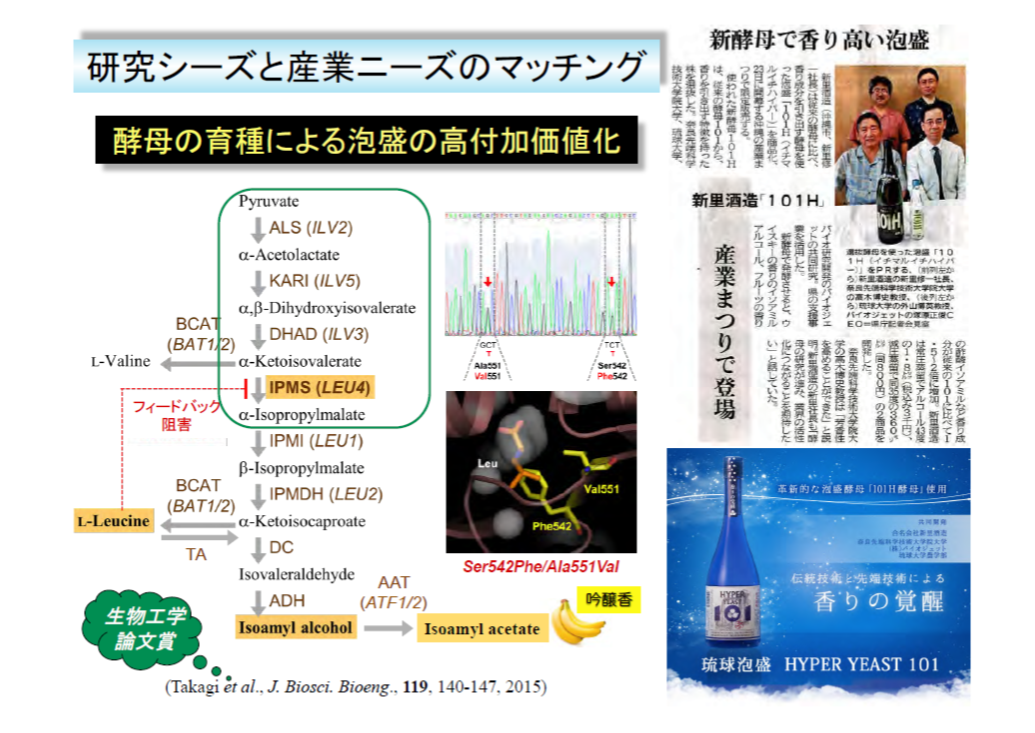
- ストレス耐性機構の高機能化と高度利用による産業酵母の育種
<Keywords> 酸化ストレス、ROS、プロリン、トランスポーター、ミトコンドリア、N-アセチルトランスフェラーゼMpr1、アルギニン、NO、ニトロソ化、レドックス制御、活性制御(ユビキチン化、リン酸化、アセチル化)、転写因子Msn2、タンパク質リン酸化酵素Rim15、ストレス情報伝達系(TOR経路)など
上のテーマについては↓をクリック
下のテーマについては↑をクリック
酵母におけるアミノ酸の代謝制御機構・生理機能の解明と産業酵母の育種への応用
実験室酵母に見出したアミノ酸の新規な代謝制御機構と生理機能を解明するとともに、実用化可能な産業酵母の育種を目指した研究を進めています(アミノ酸機能工学)。詳しくは、こちらをご覧ください。
<Keywords> アミノ酸、代謝制御、生理機能、プロリン、アルギニン、システイン、バリン、ロイシン、リジン、オルニチン、ミトコンドリア、清酒酵母、泡盛酵母、パン酵母など
| 木俣准教授の研究内容はこちらをご覧ください |
【現在、中断中のテーマ】
□ システインの生理的役割の解明と発酵生産への応用
大腸菌におけるシステインの生理機能(レドックス制御)や代謝調節機構(合成系・排出系)を解明し、発酵生産に応用する研究を進めています。
□ 超低栄養性細菌の新奇炭酸固定経路の解明とその利用
自然界から単離した低栄養性細菌について、CO2をターゲットとした新しい代謝経路を解明し、分子レベルでの解析を通して産業応用への可能性を探ります。
□ プロテアーゼのフォールディング機構の解明と酵素機能の改変
酵素の分子機構や生理的役割を解明するとともに、タンパク質(酵素)工学によって酵素機能の改変を行い、産業への利用を試みます。
□ ストレス耐性機構を介したアルコール発酵調節機構(渡辺大輔(現・京都大学))
酵母のストレス耐性機構は、酵母が自らの有用機能を発揮するために必要であることは言うまでもありませんが、ストレス耐性機構が直接的に代謝に影響を及ぼすのかについてはまだ詳しく分かっていません。私たちは、実用酵母菌株の一種である清酒酵母に着目し、そのストレス応答について解析を行った結果、真核生物に保存されたGreatwallプロテインキナーゼであるRim15の機能欠失変異が高発酵性の原因であることを明らかにしました。現在、このRim15を介したストレス応答が、解糖系やアルコール発酵といった炭素代謝経路に及ぼす影響を遺伝子レベル・代謝レベルで解析しています。また、上記の1)~3)で紹介したようなストレス耐性機構が代謝プロファイルに及ぼす影響についても研究を進めており、様々な酵母のストレス耐性機構が有用物質生産の鍵を握ることを証明したいと考えています。
<発表論文>
- D. Watanabe, S. Tashiro, D. Shintani, Y. Sugimoto, A. Iwami, Y. Kajiwara, H. Takashita and H. Takagi: Loss of Rim15p in shochu yeast alters carbon utilization during barley shochu fermentation. Biosci. Biotech. Biochem., 83, 1594-1597 (2019).
- D. Watanabe, T. Kajihara, Y. Sugimoto, K. Takagi, M. Mizuno, Y. Zhou, J. Chen, K. Takeda, H. Tatebe, K. Shiozaki, N. Nakazawa, S. Izawa, T. Akao, H. Shimoi, T. Maeda and H. Takagi: Nutrient signaling via the TORC1-Greatwall-PP2AB55δ pathway responsible for the high Initial rates of alcoholic fermentation in sake yeast strains of Saccharomyces cerevisiae. Appl. Environ. Microbiol., 85(1), e02083-18 (2019).
- D. M. Tran, H. Takagi and Y. Kimata: Categorization of endoplasmic reticulum stress as accumulation of unfolded proteins or membrane lipid aberrancy using yeast Ire1 mutants. Biosci. Biotech. Biochem., 83, 326-329 (2019).
- T. C. Mai, T. Munakata, D. M. Tran, H. Takagi and Y. Kimata*: A chimeric mutant analysis in yeast cells suggests BiP independent regulation of the mammalian endoplasmic reticulum-stress sensor IRE1α. Biosci. Biotech. Biochem., 82, 1527-1530 (2018).
- M. Oomuro, D. Watanabe, Y. Sugimoto, T. Kato, Y. Motoyama, T. Watanabe and H. Takagi: Accumulation of intracellular S-adenosylmethionine increases the fermentation rate of bottom-fermenting brewer's yeast during high-gravity brewing. J. Biosci. Bioeng., 126, 736-741 (2018).
- D. Watanabe, M. Kumano, Y. Sugimoto, M. Ito, M. Ohashi, K. Sunada, T. Takahashi, T. Yamada and H. Takagi: Metabolic switching of sake yeast by kimoto lactic acid bacteria through the [GAR+] non-genetic element. J. Biosci. Bioeng., 126, 624-629 (2018).
- 渡辺大輔, 高木博史: お酒をつくる酵母 ―― ゲノムから解き明かす醸造特性のひみつ. 生物の科学 遺伝「発酵・醸造食品における多様な微生物の働き」, 印刷中.
- D. Watanabe, H. Takagi: Pleiotropic functions of the yeast Greatwall-family protein kinase Rim15p: a novel target for the control of alcoholic fermentation. Biosci. Biotech. Biochem., 81, 1061-1068 (2017).
- D. Watanabe, A. Kaneko, Y. Sugimoto, T. Negishi, S. Ohnuki, H. Takagi and Y. Ohya: Promoter engineering of the Saccharomyces cerevisiae RIM15 gene for improvement of alcoholic fermentation rates under stress conditions. J. Biosci. Bioeng., 123, 183-189 (2017).
- 渡辺大輔, 高木博史: ここまでわかった!きょうかい酵母(清酒用)の高発酵力を生み出すRIM15変異遺伝子. 日本醸造協会誌, 111, 638-647 (2016).
- D. Watanabe, Y. Zhou, A. Hirata, Y. Sugimoto, K. Takagi, T. Akao, Y. Ohya, H. Takagi and H. Shimoi: Inhibitory role of Greatwall-like protein kinase Rim15p in alcoholic fermentation via upregulating the UDP-glucose synthesis pathway in Saccharomyces cerevisiae. Appl. Environ. Microbiol., 82, 340-351 (2016).
- 渡辺大輔, 高木博史: 酵母のエタノール耐性:内と外から細胞を護る. 生物工学会誌, 93, 460-463 (2015).
- D. Watanabe, H. Takagi and H. Shimoi: Mechanism of high alcoholic fermentation ability of sake yeast. “Stress Biology of Yeasts and Fungi: Application for lndustrial Brewing and Fermentation” H. Takagi, H. Kitagaki (eds.) pp. 57-74 (2015).
- 渡辺大輔, 高木博史, 下飯 仁: 清酒酵母の高発酵性原因変異とその応用. 「発酵・醸造食品の最前線」(監修 北本勝ひこ), pp.101-108 (2015).
- 大矢禎一, 渡辺大輔, 岡田啓希: 酵母の形態情報を発酵・醸造に生かす. 「発酵・醸造食品の最前線」(監修 北本勝ひこ), pp.1-11 (2015).
- D. Watanabe, N. Hashimoto, M. Mizuno, Y. Zhou, T. Akao and H. Shimoi; Accelerated alcoholic fermentation caused by defective gene expression related to glucose derepression in Saccharomyces cerevisiae. Biosci. Biotechnol. Biochem., 77: 2255-2262 (2013)
- T. Inai, D. Watanabe, Y. Zhou, R. Fukada, T. Akao, J. Shima, H. Takagi and H. Shimoi: Rim15p-mediated regulation of sucrose utilization during molasses fermentation using Saccharomyces cerevisiae strain PE-2. J. Biosci. Bioeng., 116: 591-594 (2013).
- D. Watanabe, Y. Araki, Y. Zhou, N. Maeya, T. Akao and H. Shimoi; A loss-of-function mutation in the PAS kinase Rim15p is related to defective quiescence entry and high fermentation rates of Saccharomyces cerevisiae sake yeast strains. Appl. Environ. Microbiol., 78: 4008-4016 (2012).
- H. Urbanczyk, C. Noguchi, H. Wu, D. Watanabe, T. Akao, H. Takagi and H. Shimoi: Sake yeast strains have difficulty in entering a quiescent state after cell growth cessation. J. Biosci. Bioeng., 112, 44-48 (2011).