システインの生理的役割の解明と発酵生産への応用(大津、高木)
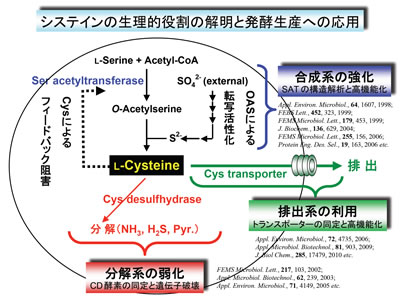
L-システイン(Cys)は、ジスルフィド結合を介したタンパク質の立体構造の維持、SH基の酸化還元反応による生体成分の代謝など生理的に重要なアミノ酸です。また、Cys類には抗酸化能があることから、食品・医薬品・化粧品などの工業原料として広く利用されています。現在、Cysはおもに毛髪や羽毛の加水分解により製造されていますが、加水分解に用いる濃塩酸の処理が環境に影響を及ぼす可能性があるため、他のアミノ酸と同様に微生物によるグルコースからの直接発酵法が望まれています。
通常、細胞内のCys含量は合成系の鍵酵素セリンアセチルトランスフェラーゼ(SAT)のCysによるフィードバック阻害と分解系の酵素Cysデスルフヒドラーゼ(CD)により厳密に制御されています。私たちは、フィードバック阻害感受性が著しく低下したSAT(大腸菌、シロイヌナズナ)を大腸菌で発現させ、Cysの過剰生産に初めて成功しました。また、大腸菌やコリネ型細菌のCDを同定し、その遺伝子破壊による分解系の抑制がCys生産に有効であることを実証しました。最近では、大腸菌ゲノム情報に基づく網羅的解析から、Cysの排出(膜透過)に関与するトランスポーター(Bcr, TolC)を同定し、排出系の強化(Bcr, TolCの過剰発現)がCys生産性を向上させることも明らかにしています。
その一方で、内膜トランスポーターの働きによってCysとシスチン(CySS)が細胞質とペリプラズムの間を循環しながらペリプラズム内の過酸化水素を消去し、細胞を酸化ストレスから防御していることを見出しました。このような大腸菌のユニークな酸化ストレス防御機構を「Cys/CySSのシャトルシステム」と名付け、詳細に解析しています。
さらに、Cysの生合成系に関しても新たなテーマに取り組み、チオ硫酸経路で生じるスルホシステインをCysへ還元する新規酵素の分子機能、チオ硫酸の選択的利用による制御機構(チオ硫酸リプレッション)の解明をめざしています。将来的には、大腸菌を用いてCysの生理機能の解明やCys発酵生産菌の育種などに役立てたいと考えています(味の素 (株) との共同研究)。
<発表論文>
- Y. Tanaka, K. Yoshikaie, A. Takeuchi, M. Ichikawa, T. Mori, S. Uchino, Y. Sugano, T. Hakoshima, H. Takagi, G. Nonaka and T. Tsukazaki: Crystal structure of a YeeE/YedE family protein engaged in thiosulfate uptake. Sci. Adv., 6, eaba7637 (2020). DOI: 10.1126/sciadv.aba7637
- Hiroshi Takagi, Iwao Ohtsu: L-Cysteine metabolism and fermentation in microorganisms. “Amino Acid Fermentation” A. Yokota, M. Ikeda (eds.), Springer, pp. 129-152 (2017).
- 高木博史: 微生物によるシステインの発酵生産と硫黄代謝の挙動. 硫酸と工業, 70, 35-46 (2017).
- 河野祐介: 手を繋ぎたい!!「硫黄」の気持ち.生物工学会誌, 93, 296 (2015).
- E. Funahashi*, K. Saiki*, K. Honda, Y. Sugiura, Y. Kawano, I. Ohtsu, D. Watanabe, Y. Wakabayashi, T. Abe, T. Nakanishi, M. Suematsu, and H. Takagi: A finding of thiosulfate pathway for synthesis of organic sulfur compounds in Saccharomyces cerevisiae and an improvement of ethanol production. *These authors contributed equally to this work. J. Biosci. Bioeng., 120, 666-669 (2015).
- I. Ohtsu, Y. Kawano, M. Suzuki, S. Morigasaki, K. Saiki, S. Yamazaki, G. Nonaka, and H. Takagi: Uptake of l-cystine via an ABC transporter contributes defense of oxidative stress in the l-cysteine export-dependent manner in Escherichia coli. PLoS One, 10(4), e0120619 (2015).
- Y. Kawano*, I. Ohtsu*, A. Tamakoshi, M. Shiroyama, A. Tsuruoka, K. Saiki, K. Takumi, G. Nonaka, T. Nakanishi, T. Hishiki, M. Suematsu, and H. Takagi: Involvement of the yciW gene in l-cysteine and l-methionine metabolism in Escherichia coli. *These authors contributed equally to this work. J. Biosci. Bioeng., 119, 310-313 (2015).
- Y. Kawano*, I. Ohtsu*, K. Takumi, A. Tamakoshi, G. Nonaka, E. Funahashi, M. Ihara, and H. Takagi: Enhancement of l-cysteine production by disruption of yciW in Escherichia coli. *These authors contributed equally to this work. J. Biosci. Bioeng., 119, 176-179 (2015).
- 大津厳生, 鈴木茉里奈, 仲谷 豪, 高木博史: システイン/シスチンのシャトルシステムによる新しい酸化ストレス防御機構. 月刊BIOINDUSTRY, 29, 53-60 (2012).
- T. Nakatani*, I. Ohtsu*, G. Nonaka, N. Wiriyathanawudhiwong, S. Morigasaki and H. Takagi: Enhancement of thioredoxin/glutaredoxin-mediated L-cysteine synthesis from S-sulfocysteine increases L-cysteine production in Escherichia coli. *These authors contributed equally to this work. Microb. Cell Fact., 11:62 doi:10.1186/1475-2859-11-62 (2012).
- 大津厳生, 鈴木茉里奈, 高木博史: 大腸菌の内膜輸送体を介したシステイン関連化合物のシャトルシステムによる酸化ストレス防御機構. 化学と生物, 50, 370-377 (2012).
- 大津厳生, 高木博史: システイン/シスチンのシャトルシステムによる新しい酸化ストレス防御機構. 化学と生物, 49, 81-83 (2011).
- I. Ohtsu*, N. Wiriyathanawudhiwong*, S. Morigasaki, T. Nakatani, H. Kadokura and H. Takagi: The L-cysteine/L-cystine shuttle system provides reducing equivalents to the periplasm in Escherichia coli. *These authors contributed equally to this work. J. Biol. Chem., 285, 17479-17487 (2010).
- N. Wiriyathanawudhiwong*, I. Ohtsu*, Z.-D. Li, H. Mori and H. Takagi: The outer membrane TolC is involved in cysteine tolerance and overproduction in Escherichia coli. *These authors contributed equally to this work. Appl. Microbiol. Biotech., 81, 903-913 (2009).
- 大津厳生:巧妙なり!タンパク質へのS-S結合導入システム. 生物工学, 86, 446 (2008).
- M. Wada and H. Takagi: Metabolic pathways and biotechnological production of L-cysteine. Appl. Microbiol. Biotech., 73, 48-54 (2006).
- S. Yamada, N. Awano, K. Inubushi, E. Maeda, S. Nakamori, K. Nishino, A. Yamaguchi and H. Takagi: Effect of drug transporter genes on cysteine export and overproduction in Escherchia coli. Appl. Environ. Microbiol., 72, 4735-4742 (2006).
- Y. Kai, T. Kashiwagi, K. Ishikawa, M. K. Ziyatdinov, E. I. Redkina, M. Y. Kiriukhin, M. M. Gusyatiner, S. Kobayashi, H. Takagi and E. Suzuki: Engineering of Escherichia coli L-serine O-acetyltransferase on the basis of crystal structure: desensitization to feedback inhibition by L-cysteine. Protein Eng. Des. Sel., 19, 163-167 (2006).
- Y. Haitani, N. Awano, M. Yamazaki, M. Wada, S. Nakamori and H. Takagi: Functional analysis of L-serine O-acetyltransferase from Corynebacterium glutamicum. FEMS Microbiol. Lett., 255, 156-163 (2006).
- N. Awano, M. Wada, H. Mori, S. Nakamori and H. Takagi: Identification and functional analysis of cysteine desulfhydrases in Escherichia coli. Appl. Environ. Microbiol., 71, 4149-4152 (2005).
- S. Kobayashi, R. Masui, S. Yokoyama, S. Kuramitsu and H. Takagi: A novel metal-activated L-serine O-acetyltransferase from Thermus thermophilus HB8. J. Biochem., 136, 629-634 (2004).
- M. Wada, N. Awano, H. Yamazawa, H. Takagi and S. Nakamori: Purification and characterization of O-acetylserine sulfhydrylase of Corynebacterium glutamicum. Biosci. Biotech. Biochem., 68, 1581-1583 (2004).
- 粟野直樹, 高木博史, 中森 茂:微生物のシステイン代謝調節機構の解明とシステイン生産菌の分子育種. 応用微生物学研究協議会誌, 2, 7-11 (2004).
- N. Awano, M. Wada, A. Kohdoh, T. Oikawa, H. Takagi and S. Nakamori: Effect of gene disruption on L-cysteine overproduction in Escherichia coli. Appl. Microbiol. Biotechnol., 62, 239-243 (2003).
- H. Takagi, K. Yoshioka, N. Awano, S. Nakamori, and B.-I. Ono: Role of Saccharomyces cerevisiae serine O-acetyltransferase in cysteine biosynthesis. FEMS Microbiol. Lett., 218, 291-297 (2003).
- M. Wada, N. Awano, K. Haisa, H. Takagi and S. Nakamori: Purification, characterization and identification of cysteine desulfhydrase of Corynebacterium glutamicum, and its relationship to cysteine production. FEMS Microbiol. Lett., 217, 103-107 (2002).
- H. Takagi, N. Awano, S. Kobayashi, M. Noji, K. Saito and S. Nakamori: Overproduction of L-cysteine and L-cystine by expression of genes for feedback inhibition-insensitive serine acetyltransferase from Arabidopsis thaliana in Escherichia coli. FEMS Microbiol. Lett., 179, 453-459 (1999).
- S. Nakamori, S. Kobayashi, T. Nishimura and H. Takagi: Mechanism of L-methionine overproduction by Escherichia coli: the replacement of Ser54 by Asn in the MetJ protein causes the derepression of L-methionine biosynthetic enzymes. Appl. Microbiol. Biotechnol., 52, 179-185 (1999).
- H. Takagi, C. Kobayashi, S. Kobayashi and S. Nakamori: PCR random mutagenesis into Escherichia coli serine acetyltransferase: isolation of the mutant enzymes that cause overproduction of L-cysteine and L-cystine due to the desensitization to feedback inhibition. FEBS Lett., 452, 323-327 (1999).
- 中森 茂, 高木博史:システイン/シスチン発酵の工業化は可能か. バイオサイエンスとインダストリー, 56, 821-822 (1998).
- S. Nakamori, S. Kobayashi, C. Kobayashi and H. Takagi: Overproduction of L-cysteine and L-cystine by Escherichia coli strains with a genetically altered serine acetyltransferase. Appl. Environ. Microbiol., 64, 1607-1611 (1998).

