酵母におけるアミノ酸の代謝制御機構・生理機能の解明と産業酵母育種への応用(アミノ酸機能工学)
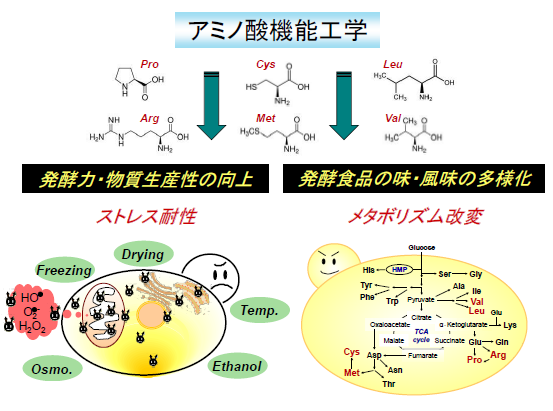
酵母のアミノ酸代謝は多岐に渡っており、その制御機構に関しても、生存環境や代謝様式などで異なっています。また、アミノ酸代謝は複雑で、かつ頑強な(ロバスト性)ネットワークを形成しており、細胞内の様々な代謝経路(代謝産物)やシグナル分子の制御系とのクロストークも存在しています。基礎科学の分野では、単細胞の真核生物である酵母の利点を活かした研究を通じて、それらの仕組みを明らかにし、生命現象の理解を深めることが可能です。一方、応用研究においては、酵母の細胞内外におけるアミノ酸含量を人為的に制御することで、高度なストレス耐性の付与による発酵食品・バイオエタノール・有用化合物の生産性改善、あるいは味・風味の差別化や健康イメージの向上を目指した酒類の製造などへの貢献が期待できます。私たちは、細胞へのストレス耐性の付与、味・風味の差別化などに寄与するアミノ酸(機能性アミノ酸)の新規な代謝制御機構と生理機能を解析し、細胞内外の含量を高めることで、有用物質の生産性向上を図る育種手法を「アミノ酸機能工学」と命名しています。
これまでに、特定のアミノ酸を高生産する菌株を古典的な育種技術(突然変異導入)により効率的に取得する方法を考案し、種々の産業酵母の高機能開発に成功しています。例えば、沖縄の伝統的蒸留酒「泡盛」は香りと味に特徴があり、それらの生成には酵母が関与しますが、泡盛酵母の育種は全く行われていません。清酒、パンの主要香気成分(吟醸香、バナナ香)である酢酸イソアミルは、前駆物質のイソアミルアルコールがエステル化して生成されます。酢酸イソアミルの生成に必須であるロイシン(Leu)の合成は、α-イソプロピルリンゴ酸合成酵素IPMSの活性がLeuによるフィードバック阻害を受けることで制御されています。私たちは沖縄のバイオジェット(株)と共同研究を行い、泡盛の高付加価値化を目指し、Leuのアナログ(5’,5’,5’-トリフルオロLeu;TFL)に耐性を示す泡盛酵母の変異株からLeu蓄積株を分離しました。泡盛の小仕込み試験を行い、親株(101-18株)に比べてLeu、イソアミルアルコール、酢酸イソアミルの含量が増加した菌株(18-T55株)を取得し、IPMSのアミノ酸置換(Ser542Phe, Ala551Val)がTFL耐性、Leu高生産、Leuによるフィードバック阻害解除の原因であることを明らかにしました(生物工学論文賞)。本研究は泡盛酵母の育種に関する初めての成果であり、アナログ耐性変異株の取得が育種に有効であることを実証しました。本菌株で製造した泡盛は香味性が向上し、特徴的な風味を有しているため、2016年5月に新里酒造(沖縄県うるま市)から商品化されています。
http://www.shinzato-shuzo.co.jp/101/index.html
また、南国イメージを有するハイビスカスの花から分離した酵母(ハイビスカス酵母)のアミノ酸アナログ耐性変異株の中から、酢酸イソアミルをはじめ香気成分が増加した株を分離し、変異遺伝子の同定とそのメカニズムを解析するとともに、これらの菌株を用いて複数の泡盛の商品化に成功しました(2018年:神谷酒造所、2019年:(有)神村酒造)。
http://www.naist.jp/sankan/content/ja/topics/20180123.html
https://bsw3.naist.jp/research/index.php?id=1862
さらに、奈良県産業振興総合センターと共同研究を行い、肝機能を向上させるアミノ酸として注目を集めるオルニチン(Orn)を細胞内に高生産する清酒酵母の変異株を取得し、同変異株を用いて醸造したOrn高含有清酒(市販の清酒の約3倍)の商品化に成功しました(2017年10月:八木酒造(株)、2018年3月:菊司酒造(株))。現在、変異株のゲノム解析を行い、Orn高生産メカニズムを解析しています。
http://www.pref.nara.jp/item/191158.htm
私たちは、必須アミノ酸として、またイソブタノール前駆体として重要なバリン(Val)にも着目しています。酵母でのValの高生産を目的に、大腸菌の情報をもとにアセトヒドロキシ酸シンターゼの調節サブユニットIlv6にアミノ酸置換(Asn86Ala, Gly89Asp,Asn104His)を導入したところ、Valによるフィードバック阻害が解除され、Val含量が著しく増加しました。また、分岐鎖アミノ酸アミノトランスフェラーゼ(Bat1/2)を解析し、ミトコンドリア局在がVal合成や細胞の生育に重要であることを見出しました。
http://www.naist.jp/pressrelease/2018/03/004320.html
最近では、これらの研究成果が評価され、酵母におけるアミノ酸の代謝制御機構や生理機能、育種・醸造などに関して蓄積した知見を活用することで、機能性アミノ酸を高含有する酵母を作製し、付加価値を高めた醤油、清酒・酒粕を開発するためのプロジェクト(キッコーマン(株)、月桂冠(株)、東北大学との共同研究)が、生物系特定産業技術研究支援センター「イノベーション創出強化研究推進事業」に採択されました。((国研)農業・食品産業技術総合研究機構 生物系特定産業技術研究支援センター「イノベーション創出強化研究推進事業(応用研究ステージ)」採択課題(2018-2020年度)
「機能性アミノ酸高含有酵母の育種技術を活用した発酵・醸造食品の高付加価値化および海外ブランド化」
http://www.naro.affrc.go.jp/laboratory/brain/innovation/files/ouyou2_06.pdf
<発表論文>
- 磯貝章太, 高木博史: 微生物におけるリジン研究の新展開. 化学と生物, 61, 54-56 (2023).
- A. Nishimura, R. Tanahashi, K. Nakagami, Y. Morioka and H. Takagi: Identification of an arginine transporter in Candida glabrata. J. Gen. Appl. Microbiol., in press. DOI: 10.2323/jgam.2023.03.003
- S. Isogai, A. Nishimura, N. Murakami, N. Hotta, A. Kotaka, Y. Toyokawa, H. Ishida and H. Takagi: Improvement of valine and isobutanol production in sake yeast by Ala31Thr substitution in the regulatory subunit of acetohydroxy acid synthase. FEMS Yeast Res., 23, foad012 (2023).
- A. Nishimura, R. Tanahashi, T. Oi, K. Kan and H. Takagi: Plasmid-free CRISPR/Cas9 genome editing in Saccharomyces cerevisiae. Biosci. Biotech. Biochem., 87, 458-462 (2023).
- R. Tanahashi, A. Nishimura, F. Morita, H. Nakazawa, A. Taniguchi, K. Ichikawa, K. Nakagami, K. Boundy-Mills and H. Takagi: The arginine transporter Can1 acts as a transceptor for regulation of proline utilization in the yeast Saccharomyces cerevisiae. Yeast, 40, 333-348 (2023).
- R. Tanahashi, A. Nishimura, M. Nguyen, I. Sitepu, G. Fox, K. Boundy-Mills and H. Takagi: Large-scale screening of yeast strains that can utilize proline. Biosci. Biotech. Biochem., 87, 358-362 (2023) DOI: 10.1093/bbb/zbac202
- 高木博史: 「アミノ酸機能工学」による酵母の高機能開発と酒類産業への応用. 日本醸造協会誌, 117, 823-837 (2022).
- 高木博史: 機能性アミノ酸高含有酵母の育種技術を活用した発酵・醸造食品の高付加価値化. 食品と開発, 57, 4-9 (2022).
- M. Tsukahara, S. Isogai, H. Azuma, K. Tsukahara, Y. Toyokawa and H. Takagi: Characterization of a new Saccharomyces cerevisiae isolated from banana stems and its mutant with l-leucine accumulation for awamori brewing. Biosci. Biotech. Biochem., 87, 240-244 (2023). DOI: 10.1093/bbb/zbac185
- 高木博史: アミノ酸高生産酵母の育種技術を活用した酒類の高付加価値化. 温故知新(株式会社 秋田今野商店), 59, 1-11 (2022).
- A. Nishimura, K. Ichikawa, H. Nakazawa, R. Tanahashi, F. Morita, Ir. Sitepu, K. Boundy-Mills, G. Fox and H. Takagi: The Cdc25/Ras/cAMP-dependent protein kinase A signaling pathway regulates proline utilization in wine yeast Saccharomyces cerevisiae under a wine fermentation model. Biosci. Biotech. Biochem., 86, 1300-1307 (2022).
- A. Nishimura, K. Nakagami, K. Kan, F. Morita and H. Takagi: Arginine inhibits Saccharomyces cerevisiae biofilm formation by inducing endocytosis of the arginine transporter Can1. Biosci. Biotech. Biochem., 86, 1318-1326 (2022).
- J. Koonthongkaew, N. Ploysongsri, Y. Toyokawa, V. Ruangpornvisuti and H. Takagi: Improvement of fusel alcohol production by engineering of the yeast branched-chain amino acid aminotransaminase. Applied and Environmental Microbiology, 10, e00822-22 (2022).
- 高木博史, 磯貝章太, 西村 明, 「アミノ酸機能工学」による酵母の高機能開発とその産業応用. 科学と工業, 96, 57-66 (2022).
- M. Ohashi, S. Isogai and H. Takagi: Functional analysis of feedback inhibition-insensitive variants of N-acetyl glutamate kinase found in sake yeast mutants with ornithine overproduction. Microbiol. Spectr., 10, e00822-22 (2022).
- 高木博史, 西村 明, 磯貝章太: 機能性アミノ酸高含有酵母による酒類の高付加価値化. 「発酵・醸造食品の最前線II」(監修 北本勝ひこ), シーエムシー出版, pp. 102-116 (2022).
- S. Isogai, A. Nishimura, A. Kotaka, N. Murakami, N. Hotta, H. Ishida and H. Takagi: High-level production of isoleucine and fusel alcohol by expression of the feedback inhibition-insensitive threonine deaminase in Saccharomyces cerevisiae. Appl. Environ. Microbiol., 88, e02130-21 (2022).
- A. Nishimura, S. Isogai, N. Murakami, N. Hotta, A. Kotaka, K. Matsumura, Y. Hata, H. Ishida and H. Takagi*: Isolation and analysis of a sake yeast mutant with phenylalanine accumulation. J. Ind. Microbiol. Biotechnol., 49, kuab085 (2022).
- Y. Toyokawa†, J. Koonthongkaew† and H. Takagi*: An overview of branched-chain amino acid aminotransferases: functional differences between mitochondrial and cytosolic isozymes in yeast and human. Appl. Microbiol. Biotechnol., 105, 8059-8072 (2021).
- A. Nishimura, Y. Takasaki, S. Isogai, Y. Toyokawa, R. Tanahashi and H. Takagi: Role of Gln79 in feedback inhibition of the yeast γ-glutamyl kinase by proline. Microorganisms, 9(9), 1902 (2021).
- S. Isogai and H. Takagi: Enhancement of lysine biosynthesis confers high-temperature stress tolerance to Escherichia coli cells. Appl. Microbiol. Biotechnol., 105, 6899–6908 (2021).
- S. Isogai, T. Matsushita, H. Imanishi, J. Koonthongkaew, Y. Toyokawa, A. Nishimura, X. Yi, R. Kazlauskas and H. Takagi: High-level production of lysine in the yeast Saccharomyces cerevisiae by rational design of homocitrate synthase. Appl. Environ. Microbiol., 87(15), e0060021 (2021).
- H. Takagi: Adventures in Brewing Exotic Japanese Alcoholic Beverages with “Amino Acid-rich Yeast”. SIMB News , 71(1), 8-17 (2021).
- 大橋正孝, 高木博史: 酵母における機能性アミノ酸「オルニチン」高生産の仕組み. バイオサイエンスとインダストリー, 79, 108-109 (2021).
- 高木博史: アミノ酸による酵母の高機能開発と発酵・醸造食品の高付加価値化. FFIジャーナル, 226, 40-52 (2021).
- M. Ohashi, R. Nasuno, S. Isogai and H. Takagi: High-level production of ornithine by expression of the feedback inhibition-insensitive N-acetyl glutamate kinase in the sake yeast Saccharomyces cerevisiae. Metab. Eng., 62, 1-9 (2020). DOI: 10.1016/j.ymben.2020.08.005
- N. Murakami, A. Kotaka, S. Isogai, K. Ashida, A. Nishimura, K. Matsumura, Y. Hata, H. Ishida and H. Takagi: Effects of a novel variant of the yeast γ-glutamyl kinase Pro1 on its enzymatic activity and sake brewing. J. Ind. Microbiol. Biotechnol., 47, 715-723 (2020). DOI: 10.1007/s10295-020-02297-1
- J. Koonthongkaew, Y. Toyokawa, M. Ohashi, C. Large, M. Dunham and H. Takagi: Effect of the Ala234Asp substitution in the mitochondrial branched-chain amino acidaminotransferase Bat1 on the production of BCAAs and fusel alcohols in yeast. Appl. Microbiol. Biotechnol., 104, 7915-7925 (2020). DOI: 10.1007/s00253-020-10800-y
- N. S. M. Nanyan and H. Takagi: Proline homeostasis in Front. Genet., 11, 438 (2020). DOI: 10.3389/fgene.2020.00438
- 阿部峻之, 豊川洋一, 塚原正俊, 高木 博史: ハイビスカス花から単離した酵母の特性と泡盛醸造への応用. バイオサイエンスとインダストリー, 78, 18-20 (2020).
- 高木博史: 酵母の高機能開発による発酵・醸造食品の海外ブランド化. 日本醸造協会誌, 115, 1 (2020).
- N. S. M. Nanyan, D. Watanabe, Y. Sugimoto and H. Takagi: Effect of the deubiquitination enzyme gene UBP6 on the stress-responsive transcription factor Msn2-mediated control of the amino acid permease Gnp1 in yeast. J. Biosci. Bioeng., 129, 423-427 (2020). doi: 10.1016/j.jbiosc.2019.10.002.
- N. S. M. Nanyan, D. Watanabe, Y. Sugimoto, and H. Takagi: Involvement of the stress-responsive transcription factor gene MSN2 in the control of amino acid uptake in Saccharomyces cerevisiae. FEMS Yeast Res., 19, foz052 (2019).
- T. Abe, Y. Toyokawa, Y. Sugimoto, H. Azuma, K. Tsukahara, R. Nasuno, D. Watanabe, M. Tsukahara* and H. Takagi*: Characterization of a new Saccharomyces cerevisiae isolated from hibiscus flower and its mutant with L-leucine accumulation for awamori brewing. *Co-corrensponding authors. Front. Genet., 10, 490 (2019). doi: 10.3389/fgene.2019.00490.
- H. Takagi: Metabolic regulatory mechanisms and physiological roles of functional amino acids and their applications in yeast. Biosci. Biotech. Biochem., 83, 1449-1462 (2019).
- 高木博史: バリン高生産に向けた酵母の分子育種. バイオサイエンスとインダストリー, 76, 419-421 (2018).
- N. Takpho, D. Watanabe and H. Takagi*: Valine biosynthesis in Saccharomyces cerevisiae is regulated by the mitochondrial branched-chain amino acid aminotransferase Bat1. Microbial Cell, 5, 293-299 (2018).
- N. Takpho, D. Watanabe and H. Takagi*: High-level production of valine by expression of the feedback inhibition-insensitive acetohydroxyacid synthase in Saccharomyces cerevisiae. Metab. Eng., 46, 60-67 (2018).
- J.-Y. Yeon, S.-J. Yoo, H. Takagi* and H.-A. Kang*: A novel mitochondrial serine O-acetyltransferase, OpSAT1, plays a critical role in sulfur metabolism in the thermotolerant methylotrophic yeast Ogataea parapolymorpha. *Co-corrensponding authors. Sci. Rep., 8, 2377 (2018).
- 高木博史: 微生物におけるアミノ酸の代謝制御機構・生理機能の解析とその応用. 生物工学会誌, 96, 12-19 (2018). 「2017年度 生物工学功績賞 受賞」総説
- 高木博史, 渡辺大輔, 塚原正俊: 有用アミノ酸を高生産する泡盛酵母の育種と泡盛の高付加価値化への応用. 「発酵・醸造食品の最前線」(監修 北本勝ひこ), シーエムシー出版, pp.257-269 (2015).
- H. Takagi, K. Hashida, D. Watanabe, R. Nasuno, M. Ohashi, T. Iha, M. Nezuo, and M. Tsukahara: Isolation and characterization of awamori yeast mutants with L-leucine accumulation that overproduce isoamyl alcohol. J. Biosci. Bioeng., 119, 140-147 (2015). 「生物工学論文賞」受賞

