細胞移動と悪性脳腫瘍の浸潤を推進する仕組みを解明
~難治性がんの治療法開発に期待~
細胞移動と悪性脳腫瘍の浸潤を推進する仕組みを解明
~難治性がんの治療法開発に期待~
【概要】
奈良先端科学技術大学院大学(学長:塩﨑一裕)先端科学技術研究科 バイオサイエンス領域の稲垣直之教授、国立病院機構大阪医療センター 臨床研究センターの金村米博臨床研究センター長、関西医科大学の木梨達雄学長、名古屋市立大学大学院医学研究科 脳神経科学研究所の川内大輔教授らのグループは、白血球の移動とがん細胞の浸潤を推進する仕組みを明らかにしました。
白血球は私たちの体内を高速で動き回り、その移動速度は多くの細胞の約 100 倍にも達します。一方、悪性グリオーマは、成人において最も多くみられる悪性脳腫瘍であり、その速い浸潤のため進行が非常に速く、治療が極めて難しいがんです。
今回、研究グループは、シューティン 1b(注 1)というタンパク質が樹状細胞(白血球の一種)の高速移動を引き起こすことを明らかにしました。また、悪性グリオーマではシューティン 1b の働きが異常に高まることでその浸潤を促進すること、さらにシューティン 1b の働きを抑えることにより悪性グリオーマの浸潤が抑えられることを突き止めました。
本研究は、細胞が組織内で効率よく移動する仕組みを明らかにしたもので、シューティン 1b を標的とすることで、悪性グリオーマをはじめとする難治性がんに対する新たな治療戦略が切り開かれる可能性があります。
本研究成果は、医学、生物学、物理学、化学、および材料科学領域における総合科学ジャーナル Advanced Science 誌に 2025 年 8 月 13 日( 水) にオンライン公開されました( DOI : 10.1002/advs.202502074)。
【背景と目的】
細胞の移動は、免疫反応、発生、再生などの様々な生体機能に不可欠で、その異常はがん浸潤などの病態を引き起こします。細胞が体内を前進するためには(緑矢印、図 1a)、周囲の組織に対して後ろ向きの推進力を生み出す必要があります(青矢印)。移動する細胞の前方では、アクチンというタンパク質が線維状のフィラメントを形成することで突起を伸ばします(図 1b)。また、この突起の中では、アクチンフィラメントが車のエンジンの様に動きます(赤矢印)。これまでに、推進力を生み出す仕組みとして、このアクチンフィラメントの動きが連結分子(タリンやビンキュリン)を介して細胞接着分子(インテグリン)に伝わる(ピンク矢印、図 1b)ことで周囲の組織に伝わり、前進のための力(青矢印)を生み出すというモデルが提唱されています。
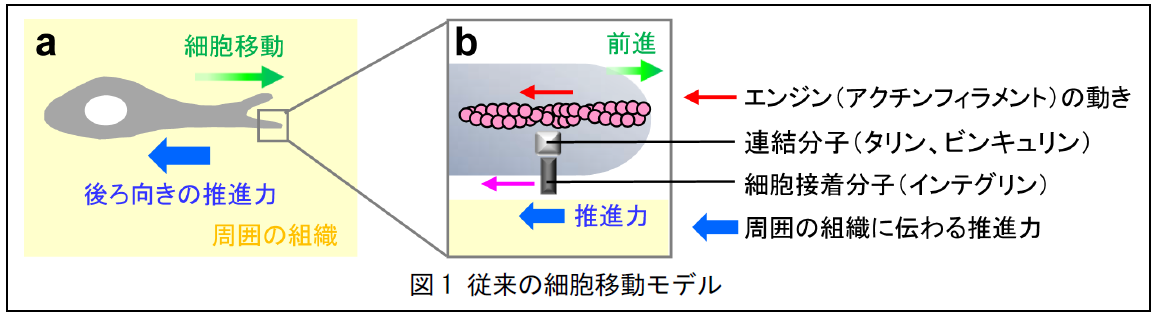
しかし、この従来のモデルでは、報告されてきた実験データを必ずしも説明することが出来ません。例えば、高速で動き回る樹状細胞のインテグリンを抑制してもその移動速度に影響はなく、T 細胞(別の白血球)のインテグリンを活性化するとむしろ移動速度は遅くなることから、異なる仕組みの存在が予想されていました。また、悪性グリオーマは、その浸潤と進行が非常に早く難治性の脳腫瘍ですが、その早い浸潤の仕組みも良くわかっていませんでした。タリンを抑制するとがん細胞の移動が早まる例も報告されています。
稲垣教授らは、これまでにシューティン 1a というタンパク質がエンジンの様に動くアクチンフィラメントと細胞接着分子 L1 を連結することで神経細胞の突起を伸ばすことを報告していました。さらに、樹状細胞や悪性グリオーマがシューティン 1b(シューティン 1a と同じ遺伝子から作られるタンパク質で、構造が一部異なる)を持つことがわかったため、樹状細胞と悪性グリオーマにおけるシューティン 1b と L1 の働きを調べました。
【研究の内容】
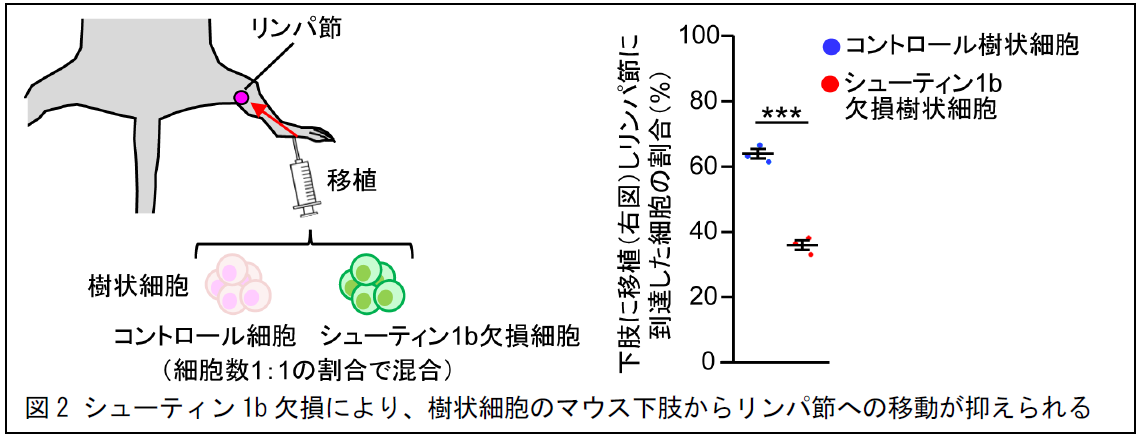
研究グループは、まず、インテグリンとは異なる仕組みとして、シューティン 1b がアクチンフィラメントと細胞接着分子L1 を連結することで樹状細胞の推進力を生み出すことを明らかにしました。また、樹状細胞の生体内の移動を調べたところ、シューティン 1b を欠損させるとその移動が抑えられました(図 2)。
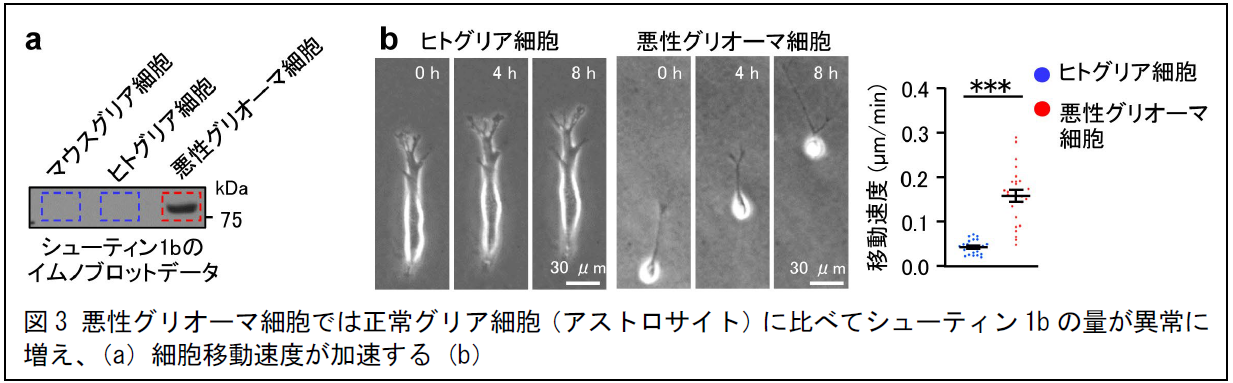
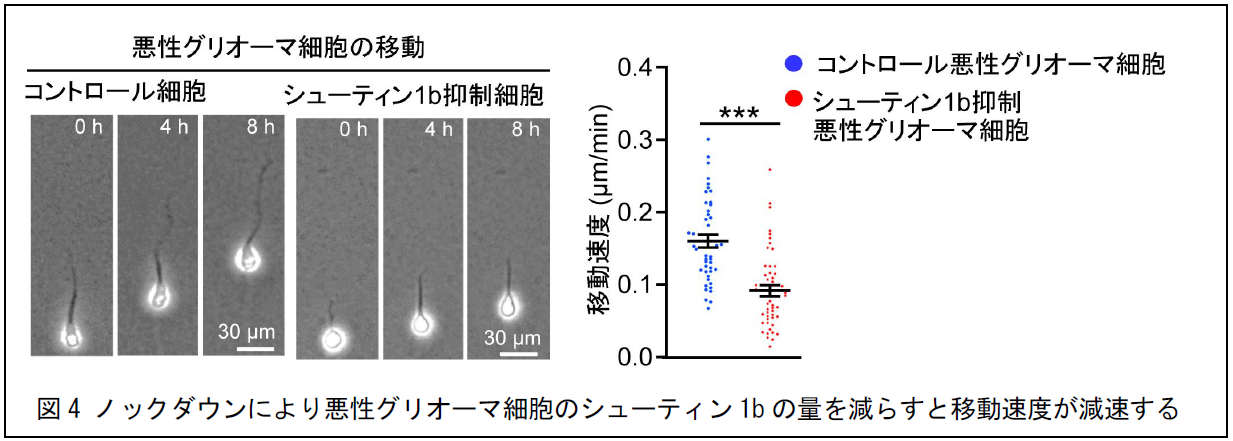
また、正常なマウスやヒトのグリア細胞ではシューティン1bの存在を確認できませんが(青枠、図3a)、がん化した患者由来の悪性グリオーマ細胞ではシューティン1bの量が異常に増えて(赤枠)その移動速度が速くなることがわかりました(図3b)。さらに、患者由来の悪性グリオーマ細胞のシューティン1bの量を減らすと移動速度が遅くなりました(図4)。また、シューティン1bの量を減らすと、悪性グリオーマ細胞のヒトiPS細胞由来の脳オルガノイドへの浸潤も抑制されました。
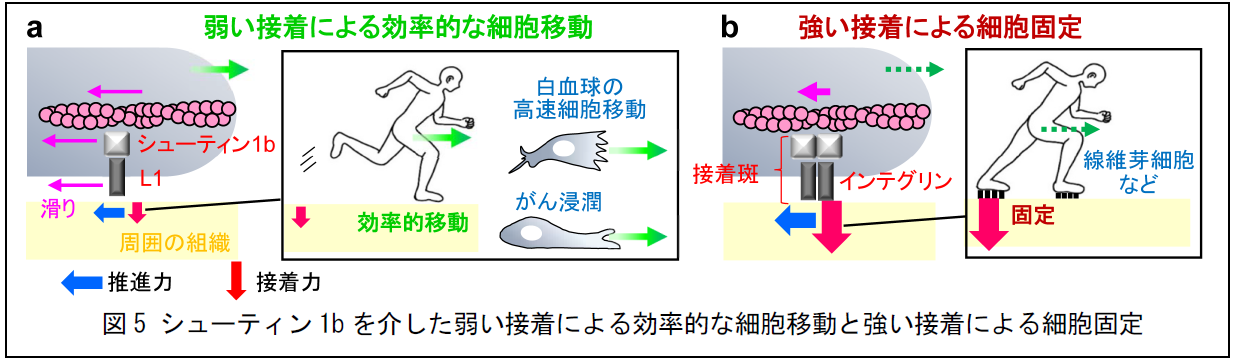
今回明らかになった、シューティン1bを介した細胞移動の仕組み(図5a)は、従来のインテグリンを介したモデル(図1b)と似ていますが、高速移動中の白血球では、L1分子が細胞外環境との間に滑りを伴う弱い接着を形成することがわかりました(ピンク矢印、図5a)。一方、皮膚の線維芽細胞などは外力を加えられてもその場所にとどまる方が都合よく、インテグリンが接着斑という強い接着構造を作ります(赤矢印、図5b)。また、強い接着は細胞を細胞外環境に固定して運動を妨げることが報告されています。そこで本研究は、アクチンフィラメントと細胞環境との連結が力の強弱に応じて細胞移動の促進と抑制の両方を担うことを提唱しました。すなわち、弱い接着は運動性を妨げることなく高速細胞移動に適しています(図5a)。一方、強い接着は、生理的条件下で動き回る必要のない線維芽細胞などをその場に留める働きがあると考えられます(図5b)。
【今後の展開】
本研究の学術的意義は、これまで矛盾点のあった従来の細胞移動のモデルを力の強さという視点から見直して、弱い接着の重要性を見出した点にあり、今後、様々な細胞運動の理解が進むことが期待できます。
また、悪性グリオーマは、成人において最も多くみられる脳腫瘍で、その高い浸潤性のため、5年生存率が5%程度と治療が大変難しい病気です。本研究では、悪性グリオーマにおいてシューティン1bの働きが異常に高まることで移動を促進すること、さらにシューティン1bの働きを抑えることにより悪性グリオーマの浸潤が抑えられることを突き止めました。本研究成果により、悪性グリオーマをはじめとする難治性がんに対する新たな治療戦略が切り開かれる可能性があります。
【謝辞】
本研究は、国立研究開発法人日本医療研究開発機構(AMED)の革新的先端研究開発支援事業(AMED-CREST)「メカノバイオロジー機構の解明による革新的医療機器及び医療技術の創出」研究開発領域における研究開発課題「細胞-基質間の力を基盤とした細胞移動と神経回路形成機構の解明およびその破綻による病態の解明」(研究開発代表者:稲垣 直之)および日本学術振興会(JSPS)科学研究費、大阪難病研究財団、NAIST生命科学研究基盤センターによる支援によって実施しました。
【用語解説】
注1 シューティン1b:
神経軸索の伸長を担うタンパク質シューティン1aのスプライシングバリアント(同じ遺伝子から作られる異なるタンパク質)として稲垣教授のグループで発見された。樹状細胞がシューティン1b を持つことが知られていた(Higashiguchi et al., Cell Tissue Res., 2016)。成体のマウス脳では、シューティン1bをほとんど検出することが出来ない。
【掲載論文】
タイトル:Weak and tunable adhesion-clutch drives rapid cell migration and glioblastoma invasion
著者:馬場健太郎1, 福士亜美1, 森﨑恵海1, 武内良介1, Xiao Zhize 2, 長嶋慶和1, 酒井瑞貴1, 東口泰奈1, 勝野弘子1, 勝間亜沙子1,3, 植田祥啓4, 上岡裕治4, 川内大輔2, 木梨達夫4, 金村米博3, 稲垣直之1,*
1:奈良先端科学技術大学院大学 先端科学技術研究科 バイオサイエンス領域 神経システム生物学研究室
2:名古屋市立大学大学院医学研究科 脳神経科学研究所 腫瘍・神経生物学分野
3:国立病院機構大阪医療センター 臨床研究センター
4:関西医科大学付属生命医学研究所 分子遺伝学部門
*責任著者
掲載誌:Advanced Science
DOI:10.1002/advs.202502074
【神経システム生物学研究室】
研究室紹介ページ:https://bsw3.naist.jp/courses/courses204.html
研究室ホームページ:https://bsw3.naist.jp/inagaki/
(2025年08月29日掲載)
 奈良先端科学技術大学院大学
奈良先端科学技術大学院大学