タンパク質分子が細胞膜を通り抜ける過程の可視化に成功
〜ナノスケールの生命活動の動的な分子メカニズムの解明に新たな道拓く〜
タンパク質分子が細胞膜を通り抜ける過程の可視化に成功
〜ナノスケールの生命活動の動的な分子メカニズムの解明に新たな道拓く〜
<発表のポイント>
●細菌の生体膜をタンパク質が透過する際に、通り道を形成するSecYEG-SecAという膜タンパク質複合体を用い、実際にタンパク質が膜を通過する過程を高速原子間力顕微鏡(HS-AFM※1)により、世界で初めてリアルタイムで可視化しました。
●詳細な画像解析からSecAの動的な構造変化(タンパク質を透過させる可働領域の位置が「High(高い)」と「Low(低い)」の上下運動を繰り返す状態)を捉え、この変化は透過のエネルギーを供給するATP加水分解サイクルと連動していることを示しました。
●タンパク質輸送速度が1秒間に約2.2アミノ酸残基であることを推定しました。本測定手法は、他の膜タンパク質の動態解明にも応用可能です。
【概要】
奈良先端科学技術大学院大学(学長:塩﨑一裕)先端科学技術研究科バイオサイエンス領域構造生命科学研究室の塚崎智也教授らの研究グループは、名古屋大学大学院理学研究科の金岡優依博士後期課程学生、内橋貴之教授(兼自然科学研究機構生命創成探究センター客員教授)、東京理科大学の森貴治准教授との共同研究により、細菌のタンパク質膜透過装置SecYEG-SecA複合体の1ユニットを用いて、タンパク質の膜通過の過程を、高速原子間力顕微鏡(HS-AFM)によって初めてリアルタイムで可視化することに成功しました。
生体膜は、細胞を外界から保護する重要な構造ですが、タンパク質などの高分子は通常、この膜を透過できません。そのため、生体膜にはSecというタンパク質からなる複合体が存在し、タンパク質を膜透過させる装置として働いています。この装置は、タンパク質が3次元構造を持ち機能する成熟した段階では通さず、未成熟で紐状のタンパク質を透過させます(※2)。しかし、これまでに多くの解析が行われてきたものの、実際に作動中のタンパク質膜透過装置を視覚的に捉えた例はありませんでした。
今回の研究では、ナノディスクと呼ばれるナノ粒子に、1ユニットのSecYEG-SecA ATPase複合体を埋め込み、さらに、膜透過する紐状のタンパク質とエネルギー源ATPを加えることで、タンパク質の膜透過反応を再現しました。この反応を、HS-AFMを用いて観測したところ、タンパク質の膜透過プロセスを動画として記録することに成功しました(動画参照)。
この画像を用いた詳細な解析では、アミノ酸の一次配列から三次元の構造を予測するAIシステムのAlphaFold(※3)によるタンパク質の予測構造も利用し、ATP 加水分解に依存したSecAの構造変化も捉えることができました。具体的には、SecAが「High」と「Low」という2つの動的な構造状態を取り、これが透過のエネルギーを生み出す ATP サイクルと連動していることを示しました。また、タンパク質の膜透過の速度が1秒間に約2.2アミノ酸残基であることを推定しました。
本研究は、タンパク質輸送の動的な分子メカニズムを解明する新たな道を切り開くものであり、基礎生物学の発展および他の膜タンパク質のナノスケールの動態解明にも応用可能な技術となります。本研究成果は、国際科学雑誌「Nature Communications」に、2025年1月8日(水)午前10時(ロンドン時間)に公開されます(DOI:10.1038/s41467-024-54875-x)。
【背景と目的】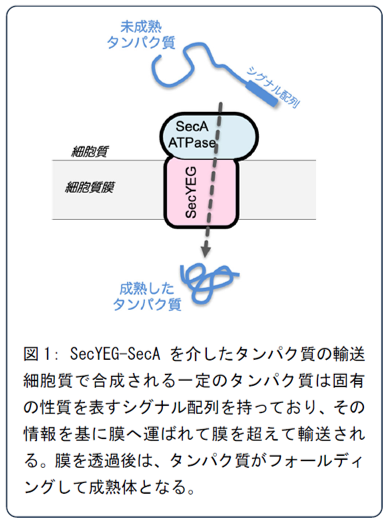
生体膜により細胞は外部環境と隔離する重要な役割を果たしますが、多くの高分子はこの膜を自由に通過することができません。細胞内で合成されたタンパク質の多くは、機能を果たすために膜を越えて特定の場所へ輸送される必要があります。そのため、すべての生物はSecトランスロコンと呼ばれる膜タンパク質複合体を備えています。細菌のSecトランスロコンはSecYEG複合体で構成され、タンパク質透過孔を形成し、未成熟で紐状のタンパク質を通すことができます。このタンパク質の輸送は、共同して働くSecA ATPase(ATP加水分解酵素)によって駆動されます(図1)。
これまでの様々な研究において、SecYEG-SecA複合体が単一ユニットで膜透過反応を起こすとされていましたが、実際に1ユニットでタンパク質を輸送している動的な状態をリアルタイムで観察した例はありませんでした。本研究では、サンプルの調製方法を最適化し、高速原子間力顕微鏡(HS-AFM)を用いて、SecYEG-SecA複合体が1ユニットで働いている様子を動画として捉えることを目指しました。
【研究の内容】
本研究では、SecYEG-SecA複合体によるタンパク質膜透過の動的プロセスを観察するため、サンプル調製と観察手法の最適化を行いました。SecYEGとSecAは、生体内では結合と解離を繰り返す特性があり、そのままでは直接的な観察が難しいという問題がありました。そこで、SecYとSecAを人工的に連結した融合タンパク質を使用することで、安定な複合体を得ました。さらに、そのSecYEG-SecA複合体を、脂質と膜骨格タンパク質で作られた「ナノディスク」と呼ばれるナノ粒子に再構成し、単一ユニットのサンプルを準備しました。
膜透過する基質タンパク質として、未成熟の紐状タンパク質であるproOmpAのC末端(膜透過する後半側)に蛍光タンパク質sfGFPを融合させたタンパク質を用いました。sfGFPは非常に安定な構造をもち紐状構造をとらないため、観察が困難な紐状タンパク質の末端の目印としました。
実験では、まず、SecYEG-SecA含有ナノディスクと、proOmpA-sfGFPを混合し、HS-AFMで観察しました。サンプルは、劈開マイカ(雲母)表面に載せて測定を行いました。画像ではSecYEG-SecAの1ユニットにproOmpA-sfGFP が結合している複合体が確認できました(図2)。
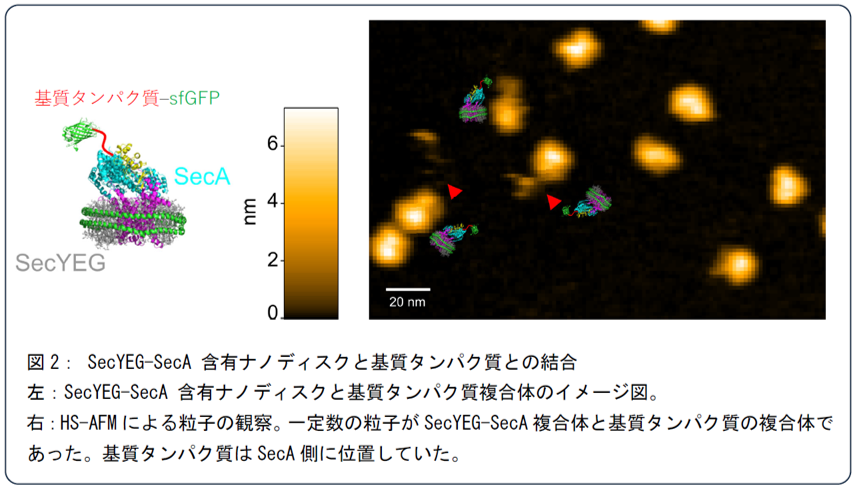
図2ではATPを加えていない条件であり、タンパク質の膜透過反応は起こらず、基質タンパク質はSecA側にとどまっていました。この条件にATPを加えることで、膜透過反応を誘導し、SecYEG-SecA複合体が1ユニットとして機能し、タンパク質膜透過装置が動作する様子をリアルタイムで記録することに成功しました(動画、図3)。画像では実際に紐状の基質タンパク質が時間とともに、SecA側(図では上側)からSecYEG側(図では下側)へ、膜透過していく様子をとらえていました。この結果は、1ユニットのSecYEG-SecA複合体がタンパク質の膜透過を実行可能であることを明確に示す、確固たる証拠となりました。

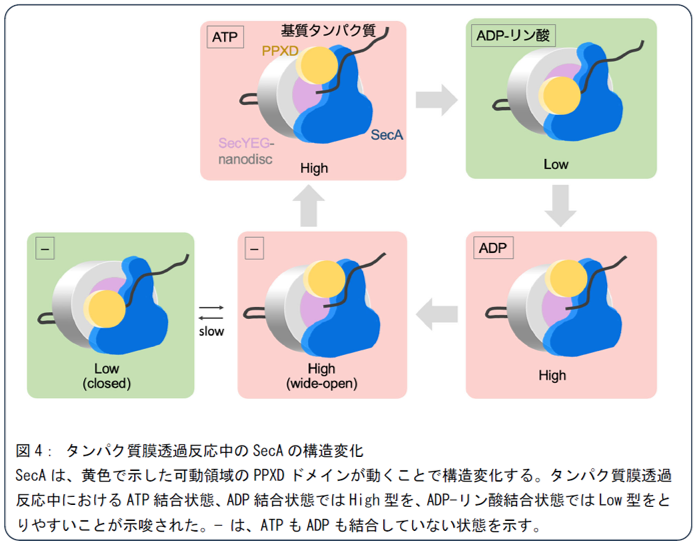
SecAはATP加水分解に伴って構造変化をすることが知られていますが、HS-AFMで得られた画像を詳細に解析することでSecAの構造変化も見出すことに成功しました。SecYEG-SecA含有ナノディスクの詳細な構造モデルをAlphaFoldと分子動力学計算(※4)を用いて構築し、HS-AFMの画像と比較検討することで、SecAがタンパク質膜透過中に「High」と「Low」という2つの異なる構造パターンを取ることが明らかになりました。これら2つの状態が、これまでに報告されているSecAの「wide-open」型および「closed」型に相当することを示しました。さらにヌクレオチドの種類を変更して実験を行い、SecAがとる構造状態の割合を調べました。その結果図4に示すように、SecAの構造状態はATPサイクルに連動して変化しており、この構造変化が基質タンパク質の膜透過を駆動する上で重要な役割を果たしていることが示唆されました。また、タンパク質が輸送された画像から輸送速度を解析したところ、この実験系では1秒間に約2.2アミノ酸残基が輸送される速度で基質タンパク質が膜を通過していることが推定されました。(図4)
本研究は、SecYEG-SecA複合体の単一ユニットがタンパク質を膜透過させる動的なプロセスを、リアルタイムで観察した初めての例であり、タンパク質輸送の理解を大きく前進させる成果です。
【今後の展開】
本研究では、これまで視覚的に捉えることが困難であったタンパク質の輸送プロセスをリアルタイムで観察することに成功した点が、極めて大きな成果であり、大きな手応えを感じています。本研究で示したSecA ATPaseの構造変化のサイクルは、生体内タンパク質輸送システム全般の理解のために貴重な情報を提供します。今後は、本研究をさらに発展させ、Sec複合体によるタンパク質輸送の詳細な解析を進めるとともに、この手法を応用して他の膜タンパク質の動的解析を進めていきたいと考えています。
【用語解説】
※1 高速原子間力顕微鏡(HS-AFM):バイオサイエンス領域においては、水溶液中のタンパク質などの生体分子を、リアルタイムで画像取得できる。時間分解能は数十ミリ秒、空間分解能は1nm程度であり、ナノ(10憶分の1)メートルオーダー粒子の動的解析が可能である。
※2 未成熟で紐状のタンパク質の透過:タンパク質はアミノ酸が連結したポリペプチドであり、多くの場合ポリペプチドがフォールドして(折りたたまれて)ある特定の構造体を形成し機能する。
本研究が取り扱うタンパク質の膜透過では、そのフォールディングの前の状態、すなわちポリペプチドが紐状の状態で輸送される。
※3 AlphaFold:今年のノーベル化学賞の対象となったAIによるタンパク質構造予測のシステム。
※4 分子動力学計算:分子動力学(Molecular Dynamics)を用いて、タンパク質などの生体分子の挙動を計算する研究手法。MDシミュレーション。
【掲載論文】
タ イ ト ル :AFM observation of protein translocation mediated by one unit of SecYEG-SecA complex
(原子間力顕微鏡による 1 ユニットのSecYEG-SecA複合体を介したタンパク質の膜透過の観察)
著者:Yui Kanaoka, Takaharu Mori, Wataru Nagaike, Seira Itaya, Yuto Nonaka, Hidetaka Kohga, Takamitsu Haruyama, Yasunori Sugano, Ryoji Miyazaki, Muneyoshi Ichikawa, Takayuki Uchihashi, Tomoya Tsukazaki
(金岡 優依、森 貴治、長池 航、板家 成良、野中 雄仁、甲賀 栄貴、春山 隆充、菅野 泰功、宮﨑亮次、市川 宗厳、内橋 貴之、塚崎智也)
掲載誌:Nature Communications
DOI:10.1038/s41467-024-54875-x
【構造生命科学研究室】
研究室紹介ページ:https://bsw3.naist.jp/courses/courses309.html
研究室ホームページ:https://bsw3.naist.jp/tsukazaki/
(2025年01月09日掲載)
 奈良先端科学技術大学院大学
奈良先端科学技術大学院大学