細胞の膜の形を変えて整えるタンパク質の集合機構を初めて解明
~免疫反応やがん細胞の転移の動的な仕組みの究明に期待~
細胞の膜の形を変えて整えるタンパク質の集合機構を初めて解明
~免疫反応やがん細胞の転移の動的な仕組みの究明に期待~
【概要】
奈良先端科学技術大学院大学(学長:塩﨑 一裕)先端科学技術研究科 バイオサイエンス領域 分子医学細胞生物学研究室の末次 志郎 教授の研究グループは、がん細胞が移動する際や免疫細胞が病原体などを包み込んで消化する「食作用(ファゴサイトーシス)」の際に、異物の取り込み口となる突出したカップ型の構造(ファゴサイトーシスカップ)を形成するため、生体膜(脂質膜(*1))上にタンパク質が集合し、規則正しく並ぶように制御されるという機構を初めて明らかにしました。免疫応答やがん細胞の転移など細胞の形の動的な変化を伴う病気の解明にもつながると期待されます。
多数のアミノ酸が連結したタンパク質の分子構造の中には、独立した機能を持つ部分(ドメイン)が含まれていますが、末次教授らは、生体膜の形態形成を担う機能を持つ「BARドメイン」に注目し、研究を行ってきました。BARドメインが生体膜に結合することによって、そのドメインを含むタンパク質が集まり、ブロックを連結するように形を作ることで、生体膜の形態を整えるのです。 これまで、「GAS7」というタンパク質に含まれる BAR ドメインの解析を行い、2019年にGAS7が細胞全体の比較的大きな部分を占めるファゴサイトーシスカップの形成に適した平面状の生体膜に集合することを報告しています。
今回は、GAS7が生体膜上に集合し、ファゴサイトーシスカップを形成して機能するまでの機構を調べました。その結果、異物を感知してファゴサイトーシスを起こす細胞膜の受容体に情報を伝達するタンパク質群と、ファゴトーシスの過程でアクチンを制御することが知られていたタンパク質(WASPファミリータンパク質)の間のタンパク質同士の多数の結合によって、ファゴサイトーシスカップの形成が制御されていることがわかりました。この様な多数の結合によるタンパク質の集合は、液‒液相分離(liquid‒liquid phase separation: LLPS)として知られ、このようなタンパク質の凝集体は、タンパク質の制御機構として注目を集めています。今回解析を行ったGAS7を含む構造体は、LLPS様の機構を取るものの、生体膜の形態に適合するように、秩序だった集合様式をとることがわかりました。さらに、脂質膜上でのLLPS様の構造は、さらなるタンパク質の集積を促し、細胞の応答を支配する可能性があります。
本研究成果は、BARドメインの集合機構を具体的に明らかにした初めての知見であり、免疫応答機構のみならず、がん細胞の転移など細胞の形態変化を伴う現象に対する生命の根源的な理解を深めます。同時に詳細な分子機構の解明は、免疫細胞などの機能を操作する新たな医療の実現に道を開きます。この研究成果は、米国時間(夏時間)の2023年4月26日(水)午後2時【プレス解禁日時:日本時間2023年4月27日午前3時】付でAAASの学術誌「Science Advances」オンライン版に掲載されます。
また、本研究成果は、科学研究費補助金 基盤研究(B)、基盤研究(S)、国際共同研究(A)、戦略的創造研究推進事業 チーム型研究(CREST)、武田科学振興財団などの事業・研究領域・研究課題によって得られました。
<論文タイトル>
Small GTPase Cdc42, WASP, and scaffold proteins for higher order assembly of the F-BAR domain protein (低分子量Gタンパク質Cdc42とWASPおよび足場タンパク質は、F-BARドメイン持つタンパク質の高次集合を制御する)
doi:10.1126/sciadv.adf5143
【解説】
細胞は生体膜によって構成されています。生体膜は、脂質膜(*1)により形成されています。細胞の持つ脂質膜の形態は多様なことが知られていて、その形は、細胞の機能と密接に関わっています。輸送すべき物質と結合した脂質膜の微小領域がくびれて切り離され、小胞となり、脂質膜と一緒に輸送される現象が、細胞内の物質輸送において知られています。この現象は、より大きな病原体などの外敵や異物を取り込んで消化する、免疫応答などにおいても見られます。
細菌やウイルスなどの病原体を含む異物が、マクロファージなどの免疫細胞によって取り込まれ、消化される過程は、ファゴサイトーシスと呼ばれ、重要な防御機構となっています。その場合、細胞表面の生体膜、すなわち、細胞膜が突出し、病原体や異物を包み込み、その後、細胞内に取り込みます。この構造は、ファゴサイトーシスカップと呼ばれます。また、細胞が移動したり、神経突起が伸長したり際にも、細胞膜の突出構造の形成が見られます。
ファゴサイトーシスは、生体にとって異物と認識される物の中で、細胞にとっては比較的大きめの直径が数マイクロメートルから数十マイクロメートルの病原微生物やウイルス、あるいは死んだ細胞やその他の微粒子を細胞が取り込む過程です。マクロファージや好中球、単球などの主に免疫細胞において活発に行われ、生体防御機構として重要であると考えられています。具体的には、ファゴサイトーシスカップと呼ばれる構造が、細胞の表面から突出して形成され、異物を包み込むようにして取り込み、消化します。ファゴサイトーシスカップの形成機構は、細胞膜が突出する構造体であるラメリポディア(葉状仮足:細胞の移動に関与)との類似性が指摘されていましたが、その詳細な形成機構は明らかではありませんでした。
末次教授らは、Bin-Amphiphysin-Rvs(BAR)ドメインと呼ばれるタンパク質ドメインの解析を行ってきました。BARドメインは、湾曲したカーブ構造をしており、柔軟な脂質膜に結合することで、それを含むタンパク質の形を鋳型として、異物を取り込む小胞などの脂質膜の形態を形成します。このように生体膜の形を制御するタンパク質としては、ほとんど唯一知られているタンパク質です。BARドメインは、BAR、F-BAR、I-BARの3種に大別されます。この中で、I-BARドメインは主に細胞突起形成に関与すること、F-BARドメインおよびBARドメインは、主にエンドサイトーシス(飲食作用)に関与することがわかっています。BARドメインは、脂質膜上で、タンパク質集合を起こすことにより、ブロックを積み重ねるようにして脂質膜の形状を形成するドメインであることがわかっています。BARドメインは、ヒトにおいては73種あり、それぞれ異なる脂質膜の構造形成に関与していると考えられていますが、そのブロックの様な集合がどのように制御されているかについては明らかではありませんでした。
今回、2019年に構造解析に成功していた、ファゴサイトーシスに関与するGAS7がどのような機構でブロックのように連結し、機能するかについて調べたところ、異物の侵入を感知してファゴサイトーシス稼働の情報を伝える受容体の下で、細胞内のシグナル伝達を担うタンパク質群と、ファゴサイトーシスの過程で関与するWASPファミリータンパク質の間のタンパク質同士の多数の結合によって、制御されていることがわかりました。この様な多数の結合によるタンパク質の集合は、液‒液相分離(liquid‒liquid phase separation: LLPS)として知られています。LLPSによるタンパク質の凝集体形成は、タンパク質の制御機構として注目を集めています。今回は、GAS7は、WASPファミリータンパク質や他のアダプタータンパク質とともに、LLPS様の集合機構を取るものの、生体膜の形態に適合するように、秩序だった集合をとることがわかりました。
WASPファミリータンパク質は、細胞の形態制御に関与するアクチン繊維を制御することが知られていて、免疫不全症などで変異が生じる例があります。シグナル伝達を担うタンパク質群はWASPファミリータンパク質に結合し、細胞膜の受容体の活性化に応じて、受容体の近傍にWASPファミリータンパク質を局在化させます。WASPファミリータンパク質には、シグナル伝達を担うタンパク質が複数個、同時に結合できます。また、シグナル伝達を担うタンパク質は、複数のWASPファミリータンパク質やBARドメインタンパク質に同時に結合できます。この様な複数の結合は、タンパク質の凝集様の集合を誘導し、この凝集形成が、タンパク質の濃度を制御することで、生命現象を制御することが近年解明されてきています。この多数の結合による分子集合現象は、液体中に溶けたタンパク質が凝集し、液中で分離して観察されることから、液‒液相分離(liquid‒liquid phase separation: LLPS)と呼ばれています。
今回は、LLPS様の多数の結合によるタンパク質の凝集様の集合が、生体膜の上でのBARドメインの秩序だった集合にも関与していることがわかりました。また、逆に、BARドメインの集合はLLPS様であることから、さらなるタンパク質の集積を促し、細胞の応答を支配する可能性があります。
本研究成果は、BARドメインの集合機構を具体的に明らかにした初めての知見であり、免疫応答機構のみならず、細胞の形態変化を伴う生命現象の根源的な理解を深めます。また、詳細な分子機構を明らかにすることで、将来の免疫細胞などの機能を操作する新たな医療の道を開く可能性があります。
【今後の展開】
BARドメインタンパク質の集合機構は、さまざまな細胞の微細構造構築にとって重要であることから、それぞれの細胞の形態を制御することにより、生命現象そのものを制御し、医療などに役立てる道を開きます。その中には例えば、免疫反応の一種であるファゴサイトーシスや、がん細胞の転移における細胞運動などが含まれます。
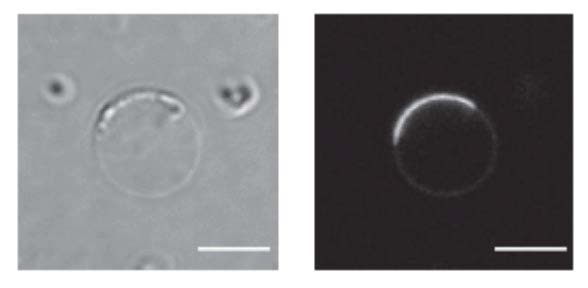
図1 脂質膜の上でLLPS様の気候によって集合するGAS7タンパク質の顕微鏡写真。左は、研究に使った人工脂質膜。右は、人工脂質膜に集合し、ブロックのように結合して湾曲した形を作るGAS7タンパク質(蛍光タンパク質を付加して光らせています)。写真下部の縮尺を表すスケールバーは5マイクロメートルです。
(*1)脂質膜:生体膜は脂質分子が並列した脂質膜により構成されます。この脂質分子は、水になじむ親水性部分と水になじまない疎水性の部分からなる両親媒性脂質で、水溶液中では疎水性の部分が水中で向き合い、親水性の部分が水溶液に面しています。生体膜を構成する両親媒性脂質として代表的なものに、フォスファチジルセリン、フォスファチジルコリン、フォスファチジルエタノールアミンなどがあります。
【分子医学細胞生物学研究室】
研究室紹介ページ:https://bsw3.naist.jp/courses/courses210.html
研究室ホームページ:https://bsw3.naist.jp/suetsugu/
(2023年04月27日掲載)
 奈良先端科学技術大学院大学
奈良先端科学技術大学院大学