ミトコンドリア外膜における SAM 複合体がタンパク質を膜挿入するメカニズムの構造基盤
構造生命科学研究室の竹田弘法助教らがSAM複合体によるβバレル構造形成の仕組みを明らかにしました。
【概要】
ミトコンドリアはエネルギー分子であるATPを産生する、真核生物に必須の細胞小器官です。ミトコンドリアが正常に機能するためには、細胞質で合成されたタンパク質をミトコンドリア内に取り込み、適切な区画に配送しなければなりません。これを行うのがトランスロケーターと呼ばれるタンパク質複合体です。そのうちの一つ、SAM複合体は、ほどかれた状態の基質タンパク質をβバレル構造へと整形すると同時に、ミトコンドリア外膜へ挿入するタンパク質膜挿入装置として機能します。βバレル構造とは、基質タンパク質を構成する10個ほどのアミノ酸が棒状に伸び (βストランドと言います)、順番に配列することで形成される筒状構造のことです。それでは、どのようにして SAM 複合体は基質タンパク質をβバレル構造へと成熟させ、かつ膜内へ挿入するのでしょうか。
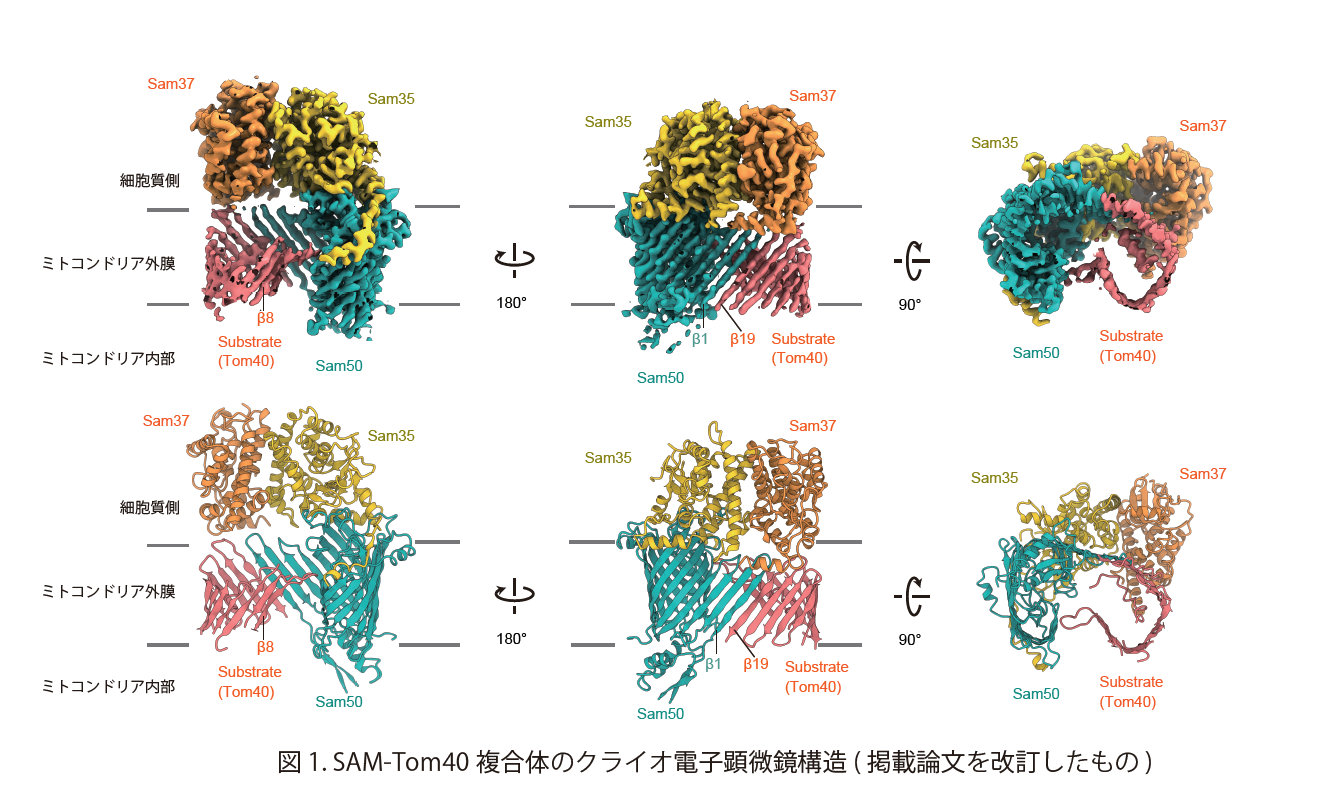
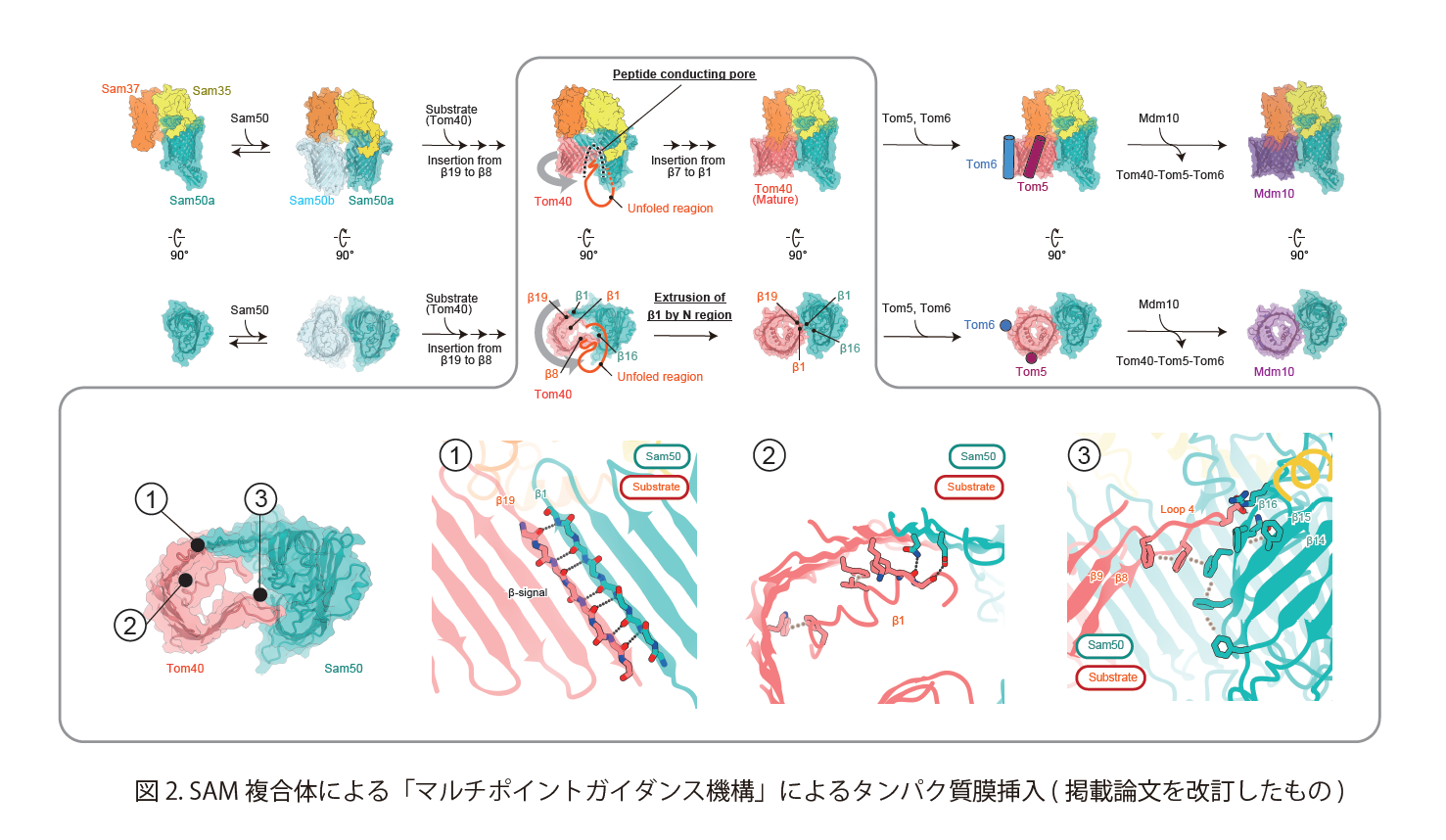
私たちは、クライオ電子顕微鏡を用いて、基質タンパク質 Tom40 と結合した状態のSAM複合体の立体構造を決定することに成功しました (図1)。SAM-Tom40複合体の立体構造において、SAM複合体を構成するSam50がチャネルポアと呼ばれる構造を大きく開き、Tom40と結合していました。Sam50とTom40の結合部分では、Sam50及びTom40のβストランドが隣同士に配列することにより「混成βバレル構造」を形成していました。すなわち、Sam50 のβストランドが基質タンパク質Tom40の結合部位として働き、Tom40のβバレル構造の形成を促していることになります。さらに、基質タンパク質Tom40は合計 3 箇所でSam50と結合することがわかりました (図2)。この3箇所に変異導入を行った結果、これらの結合部位が、基質タンパク質Tom40を正確にβバレル構造へと導くためのチェックポイントとして重要であることを見出しました。我々は SAM複合体が基質タンパク質と混成β構造を形成し、複数のチェックポイントを作ることで、正確なβバレル構造へ導くこのようなメカニズムを「マルチポイントガイダンス機構」と名付け、その詳細な分子メカニズムを解明しました (図2)。
【掲載論文】
論文タイトル:A multipoint guidance mechanism for β-barrel folding on the SAM complex (SAM複合体はβバレル構造の構築を「マルチポイントガイダンス機構」によって行う)
Takeda H, Busto JV, Lindau C, Tsutsumi A, Tomii K, Imai K, Yamamori Y, Hirokawa T, Motono C, Genesan I, Wenz L, Becker T, Kikkawa M, Pfanner N, Wiedemann N, and Endo T.
Nat. Struct. Mol. Biol. (2023). DOI : 10.1038/s41594-022-00897-2
【構造生命科学研究室】
研究室紹介ページ:https://bsw3.naist.jp/courses/courses309.html
研究室ホームページ:https://bsw3.naist.jp/tsukazaki/
(2023年01月13日掲載)
 奈良先端科学技術大学院大学
奈良先端科学技術大学院大学