植物で受精卵を活性化する機構の進化的起源を解明
~雌雄の因子が出会って成長をスタートさせる~
植物で受精卵を活性化する機構の進化的起源を解明
雌雄の因子が出会って成長をスタートさせる
【概要】
奈良先端科学技術大学院大学(学長:塩﨑 一裕、奈良県生駒市)先端科学技術研究科 植物発生シグナル研究室の中島 敬二(なかじま けいじ)教授と、京都大学(総長:湊 長博、京都市左京区)大学院生命科学研究科 遺伝子特性学研究室の河内 孝之(こうち たかゆき)教授の研究グループは、グレゴール・メンデル研究所(オーストリア)との共同研究により、植物において受精卵の発生を開始させる機構の進化的起源を解明しました。コケ植物苔類のゼニゴケでは、卵細胞にあるKNOXという転写因子(遺伝子の発現を調節するタンパク質)が、精子由来のBELLという転写因子に助けられて核に移行し、受精卵の分裂を引き起こすことを突き止めたものです。
今回明らかとなったゼニゴケのKNOXとBELL転写因子の働きは、種子植物で知られていたKNOXとBELL転写因子の働きとは大きく異なっている一方で、進化上の分岐が古い緑藻類のKNOXとBELL転写因子の働きに酷似していました。このことから、受精卵の発生開始こそがKNOXとBELL転写因子の祖先的な機能であることが明らかとなりました。この成果は、植物における有性生殖の制御機構とその進化を理解する上で重要な意義を持つものであり、また植物の効率的な育種や繁殖技術の開発の基盤となる研究成果です。
【解説】
受精卵の発生開始を精密に制御することは、有性生殖において非常に重要な意味を持ちます。万一、受精していない卵が分裂すると、染色体が1セットしかない半数体が出来てしまい、減数分裂で配偶子(卵や精子)を作ることが出来ないため子孫を残せなくなります。これを防ぐために、雌雄の配偶子に由来する因子が受精卵の中に揃った時にのみ、胚発生を開始させる仕組みが備えられています。
緑藻植物のクラミドモナスでは、転写因子であるKNOXとBELLが、オスとメスの配偶子でそれぞれ発現しています。受精卵の中で両者が結合し、核に移行して遺伝子発現を調節することで、受精卵の発生(クラミドモナスは単細胞緑藻のため分裂はしない)が活性化されます。KNOXとBELLは陸上植物にも広く保存されていますが、被子植物のシロイヌナズナでも、コケ植物蘚類のヒメツリガネゴケでも、配偶子や受精卵では働いておらず、植物個体の中で分裂組織の維持や器官形態の決定に働いています。シロイヌナズナの受精卵の活性化には、クラミドモナスとは全く異なる機構が働いていることから、植物において受精卵の発生を開始させる機構の進化的な起源は不明でした。
研究グループは、コケ植物苔類のゼニゴケにおいて、KNOX遺伝子の1つのMpKNOX1が、卵細胞のみで発現していることを突き止めました。驚くべきことに、MpKNOX1遺伝子の働きは、同じコケ植物のヒメツリガネゴケや被子植物のKNOX1遺伝子の機能とは全く異なっており、むしろ緑藻であるクラミドモナスのKNOX遺伝子の働きに酷似していました。さらにゼニゴケのBELL遺伝子 (MpBELL)は、クラミドモナスのBELLと同様に受精卵におけるMpKNOX1の核移行に働いており、MpKNOX1とMpBELLが共同して、ゼニゴケの受精卵における雌雄の核の融合と、受精卵からの胚発生を促進していることが明らかとなりました。
このことから、植物において受精卵の発生を開始させる機構の進化的起源がKNOXとBELLによる受精卵の遺伝子発現制御にあることが明らかとなりました。KNOX/BELL転写因子は、コケ植物内の系統や維管束植物の系統が分岐した後に、分裂組織の維持や器官形態の決定に転用されたと考えられます。
【論文情報】
タイトル:Deep evolutionary origin of gamete-directed zygote activation by KNOX/BELL transcription factors in green plants(配偶子に依存した接合子の活性化がKNOX/BELL転写因子の緑色植物における進化的起源である)
著者:Tetsuya Hisanaga1,2, Shota Fujimoto1, Yihui Cui1, Katsutoshi Sato1, Ryosuke Sano1, Shohei Yamaoka3, Takayuki Kohchi3, Frédéric Berger2, and Keiji Nakajima1,†(久永哲也1,2、藤本翔大1、崔毅慧1、佐藤克俊1、佐野亮輔1、山岡尚平3、河内孝之3、フレデリック・ベルジェ2、中島敬二1,†)
1奈良先端科学技術大学院大学、2Gregor Mendel Institute、3京都大学、†責任著者
掲載誌:eLife 10: e57090(イーライフ、英国に本拠を置くeLife Sciences Publications Ltdが発行するオープンアクセス総合生命科学誌、Impact factor=8.14)。
DOI: https://doi.org/10.7554/eLife.57090
掲載日時:2021年9月28日(火)16時(日本時間)オンラインのみ(オープンアクセス)
【背景】
有性生殖*1においては、雌雄の配偶子(卵と精子)が受精し、二倍体の受精卵となって発生を開始する必要があります。植物におけるこの段階の制御機構に関しては、単細胞緑藻のクラミドモナスと、被子植物のシロイヌナズナにおいて一定の知見があるものの、それ以外の種においては、ほとんど明らかになっていません。またクラミドモナス*2とシロイヌナズナ*3での制御機構は互いに全く異なっており、受精卵活性化機構の進化的起源や、多様化の過程については全く分かっていませんでした。
研究グループは2016年にコケ植物のゼニゴケ(Marchantia polymorpha)*4で、生殖細胞の形成に中心的な役割を果たすMpRKD転写因子*5を発見しました(参考プレスリリースhttp://www.naist.jp/pressrelease/2016/06/003257.html)。MpRKDの変異株では成熟した卵細胞ができないため、この変異株と野生株の生殖器官の遺伝子発現を比較することで、卵細胞で強く発現する遺伝子を探索しました(図1)。研究チームは、得られた候補遺伝子の中からMpKNOX1に注目しました。MpKNOX1はTALEホメオドメイン転写因子*6をコードしており、ゼニゴケ以外の陸上植物では、分裂組織の維持や器官形態の決定に機能しています。MpKNOX1遺伝子が植物器官ではなく卵細胞で発現していたことは非常に興味深く、またMpKNOX1遺伝子の機能を調べることで、植物の有性生殖や形態形成の進化過程を明らかにできるという期待のもと、MpKNOX1遺伝子の機能を調べることにしました。

図1
【実験の結果】
本研究では、まずゼニゴケにおいて受精のタイミングを正確にコントロールできる試験管内受精系を開発しました。この系を利用してゼニゴケ受精卵とそこから生じる胚の細胞内構造を詳細に観察した結果、棍棒状に凝縮した精子の核は、受精卵の中で脱凝縮して球状の精核(雄性前核)になるものの、受精後3日間は卵の核(雌性前核)とは融合せず、4日目にようやく融合した後に、受精卵の細胞分裂が開始されることがわかりました(図2上段)。
次に、CRISPR/Cas9*7によるゲノム編集技術を用いてMpKNOX1の機能を欠損したオスまたはメスの変異株を作りました。これらの変異株は正常に成長し、野生株と同様の生殖器官や配偶子を形成しました。しかし興味深いことに、メスの変異株の卵にオスの野生株の精子を受精させたところ、受精後5日たっても雌雄の前核が融合せず、受精卵の分裂も始まりませんでした(図2下段)。反対にメスの野生株の卵に、オスの変異株の精子を受精させて得られた受精卵は正常に発生しました(図3)。このことから卵細胞に引き継がれた母方のMpKNOX1遺伝子が、受精卵での雌雄の前核の融合と、それに続く胚発生に必須である一方で、精子に引き継がれた父方のMpKNOX1は不要であることが明らかとなりました。
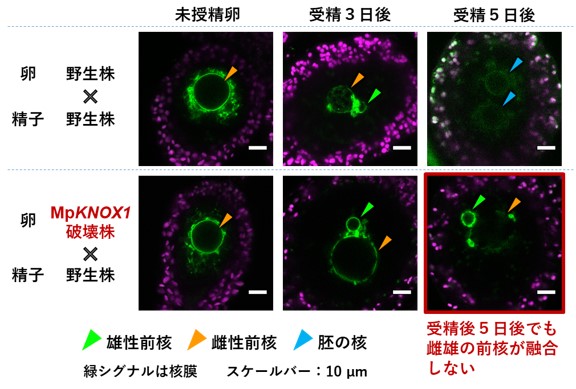
図2

図3
KNOX1転写因子は、別のTALEホメオドメイン転写因子であるBELL転写因子と結合し、二量体を形成して機能することが知られています。この知見を基に、研究グループはゼニゴケゲノムに存在する5つのBELL遺伝子(MpBELL1- MpBELL5 )のうち、MpBELL3とMpBELL4の2つが精子で強く発現していることを見出し、これらを同時に破壊した変異株を作成しました。この変異株は正常に成長したものの、受精卵の発達が阻害されていたことから、MpBELL3/4遺伝子も受精卵の発生開始に必要であることが明らかになりました。
さらに研究グループは、KNOX1転写因子の受精前後の挙動を明らかにするため、MpKNOX1と緑色蛍光タンパク質(GFP)の融合タンパク質(MpKNOX1-GFP)を発現させたメス株の卵細胞を詳細に観察しました。その結果、受精前の卵細胞ではKNOX1-GFPが細胞質にのみ存在するのに対し、野生株の精子と受精させた12時間には雌雄の前核に濃縮することが分かりました(図4上段)。興味深いことに、受精24時間後には再び細胞質においてのみMpKNOX1-GFPの蛍光が観察されました(図4上段)。MpKNOX1が転写因子であることを考慮すると、MpKNOX1は受精後12-24時間のタイミングで一過的に核に移行して遺伝子の発現を調節することが考えられました。一方でMpBELL3/4が破壊された変異株の精子を受精させた場合には、MpKNOX1-GFP の核への濃縮が起りませんでした(図4下段)。以上の観察結果から、MpBELL3/4タンパク質がMpKNOX1の核移行に必要であることが明らかとなりました。
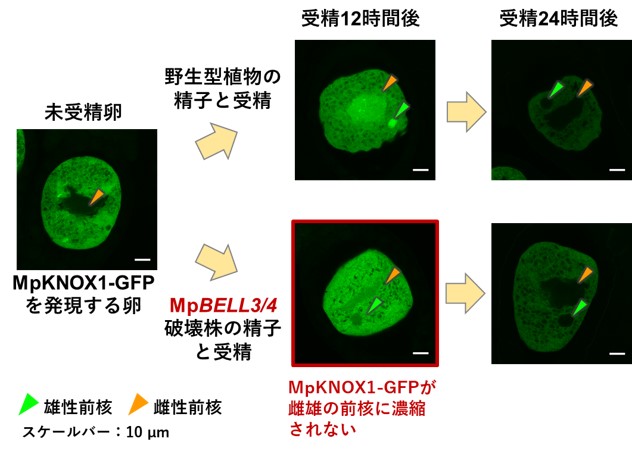
図4
【まとめと今後の展望】
以上の実験から明らかとなったゼニゴケKNOX/BELL転写因子による受精卵の活性化機構は、緑藻植物のクラミドモナスで明らかとなっているKNOX/BELL転写因子の機能に酷似しており、種子植物のシロイヌナズナや、同じコケ植物であるヒメツリガネゴケ*8のKNOX/BELL転写因子の機能とは大きく異なっていました(図5)。これにより、少なくとも陸上植物の2大系統(緑藻を含むChlorophytaと陸上植物を含むStreptophyta)が分岐した段階では、KNOX/BELL転写因子は受精卵の活性化に機能していたことが強く支持されます。
本研究により、被子植物においては茎頂分裂組織の維持や器官形態の決定因子として精力的に研究されて来たKNOX/BELL転写因子の祖先的機能が、受精卵の活性化であったことが明らかとなりました。これらの機能はヒメツリガネゴケやシロイヌナズナで明らかになっていたKNOX/BELL転写因子の機能とは一見全く異なっていますが、「二倍体世代(胞子体)の発生を制御する」という点では共通しており、KNOX/BELLが働くタイミングが、進化の過程で変化したことが示唆されます。今後は進化系統樹に沿った多くの植物種においてKNOX/BELL転写因子の機能を比較することで、この転写因子の働きの変遷過程を解明し、どのような標的遺伝子の制御を通じて異なる機能を発現させているのかを明示することで、植物発生の基本的な機構の解明に寄与することが出来ると期待されます。
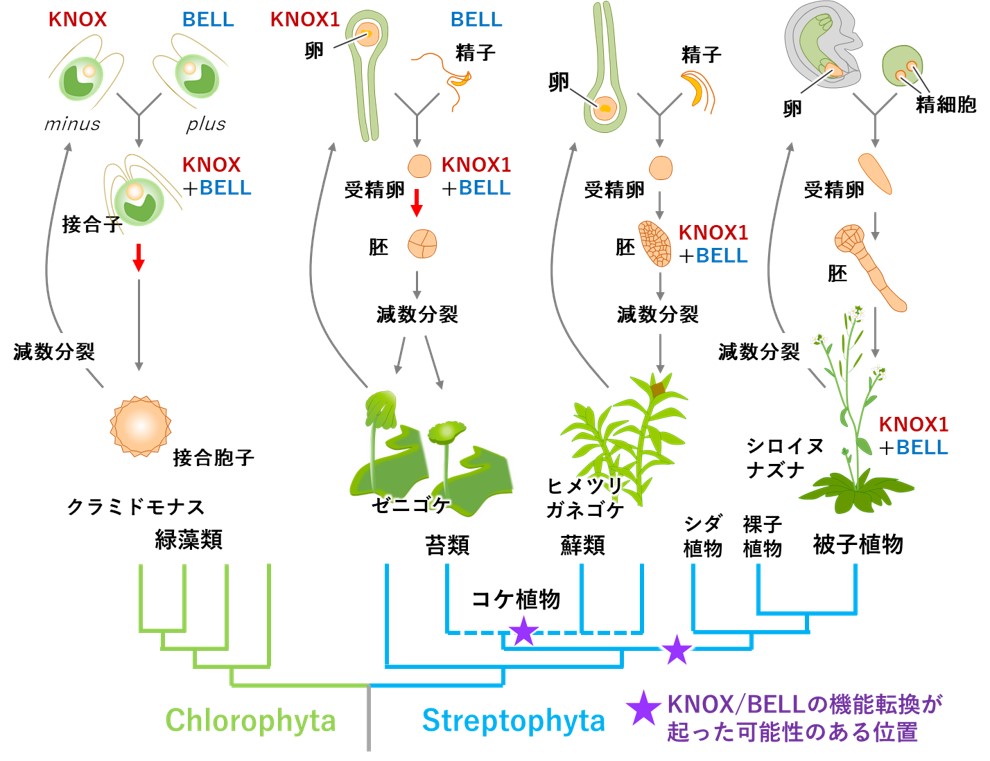
図5
【用語解説】
*1植物の有性生殖と生活環
有性生殖を行う生物の生活環では、減数分裂と受精を境として、二倍体世代と半数体世代が交互に現れる。植物の二倍体世代は減数分裂により胞子を作るため「胞子体」と呼ばれ、半数体世代は卵や精子といった配偶子を作るため「配偶体」と呼ばれる。配偶子は接合して接合子を作る。雌雄の配偶子が卵と精子に形態分化している生物では、接合子を受精卵と呼ぶ。単細胞緑藻類の接合子は多細胞化しないまま減数分裂して配偶体に戻るのに対し、陸上植物の接合子(受精卵)は複数回の分裂を経て多細胞からなる胚を作る。コケ植物では、胚は個体になることなく減数分裂して胞子を作り、それらが発芽・分裂して半数体の個体を作る(配偶体優勢の生活環。図6左)。種子植物では、胚が種子の発芽後に分裂し二倍体の個体を作る(胞子体優勢の生活環、図6右)。
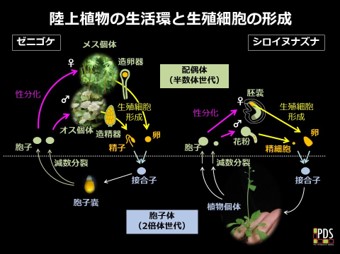
図6
*2クラミドモナス (Chlamydomonas reinhardtii)
淡水域に生息する単細胞の緑藻で、光合成や受精など広範な研究に用いられるモデル植物。半数体の配偶体と二倍体の胞子体は、ともにべん毛を持つ単細胞で、半数体世代は染色体上の性決定領域の遺伝子に依存して、プラスまたはマイナスの性を持つが、外見上は区別できない。プラス配偶子はBELL転写因子であるGSP1を、マイナス配偶子はKNOX転写因子であるGSM1を発現している。これらが受精すると受精卵の中でGSP1とGSM1が結合して核内に移行し、受精卵の発生開始に必要な遺伝子の発現を活性化させる(図5左端)。
*3シロイヌナズナ (Arabidopsis thaliana)
被子植物アブラナ科のモデル植物。最も早く全ゲノム配列が解読され、小型で世代時間が短く、一個体から数千の種が得られる等、分子遺伝学の実験に適していることから、世界中で広く用いられる。
*4ゼニゴケ (Marchantia polymorpha)
コケ植物苔類(たいるい)の1種。4億年以上前に初めて陸上生活を送るようになった共通祖先植物と似た形や性質を保持していると考えられる。転写因子の機能重複が少ないことなどから、コケ植物のモデルとして世界中で広く利用されている。オスとメスが別個体に分かれている雌雄異株植物である。
*5RKD転写因子
陸上植物の進化に保存された配偶子形成の制御因子と考えられるRWP-RK型転写因子。シロイヌナズナゲノムには5遺伝子、ゼニゴケゲノムには1遺伝子(MpRKD)が存在する。MpRKDはゼニゴケの雌雄の生殖器官で発現しており、この遺伝子をノックアウトしたゼニゴケのメス株は、成熟した卵細胞を作ることが出来ない。
*6TALEホメオボックス転写因子
遺伝子の働きを制御するホメオボックス転写因子は真核生物に共通して存在するが、それらのうちDNA結合に関与するホメオボックスのループ領域に3アミノ酸の挿入があるものを、特にTALE (Three-Amino-Acid-Loop-Extension) ホメオボックス転写因子と呼ぶ。
*7CRISPR/Cas9
細菌の獲得免疫システムにおいて機能するRNA依存型DNA切断酵素を用いたゲノム編集手法。2012年にCharpentierとDoudna(2020年にノーベル化学賞を共同受賞)により実用化が提唱されて以降、世界中で急速に普及し、様々な生物種のゲノム編集に利用されている。
*8ヒメツリガネゴケ (Physcomitrium patens)
コケ植物蘚類(せんるい)の1種。ゼニゴケと並んでモデルコケ植物として多用される。ゼニゴケと異なり1つの個体に造卵器と造精器を作る雌雄同株植物である。最近になって分類上の位置づけが修正されたことにより、属名がPhyscomitrellaからPhyscomitriumに変更された。
【植物発生シグナル研究】
研究室紹介ホームページ: https://bsw3.naist.jp/courses/courses110.html
研究室ホームページ:https://bsw3.naist.jp/nakajima/
(2021年09月30日掲載)
 奈良先端科学技術大学院大学
奈良先端科学技術大学院大学