クルクミンの抗腫瘍効果を60倍以上高めた化合物を開発
~副作用のない飲む抗がん剤の開発に期待~
クルクミンの抗腫瘍効果を60倍以上高めた化合物を開発
~副作用のない飲む抗がん剤の開発に期待~
【概要】
奈良先端科学技術大学院大学(学長:横矢直和)先端科学技術研究科 バイオサイエンス領域 腫瘍細胞生物学研究室の加藤順也教授はインドネシア ガジャマダ大学薬学部 発癌予防研究センター、長浜バイオ大学 バイオサイエンス学部、本学 情報科学領域、物質創成科学領域との共同研究により、クルクミンの60倍以上の抗腫瘍効果を持つ化合物を開発しました。
クルクミンはインドネシア料理やインドのアーユルヴェーダ医療で用いられるスパイスのターメリックの主成分で様々な効能があり抗がん効果も報告されています。クルクミンの抗がん作用は副作用が極めて少ないため有望視されているのですが、抗がん剤として作用するには大量投与が必要なため実用には不向きとされてきました。今回我々はクルクミンの関連化合物の中から極めて優れた抗がん作用を持つ化合物(PGV-1)を発見し詳細に解析しました。この結果、PGV-1はクルクミンと比べて60倍以上の増殖抑制効果を示し、細胞周期停止、細胞老化誘導、細胞死誘導など優れた抗がん作用を発揮しました。一方で正常細胞には影響を示しませんでした。また、マウスを用いた動物実験では、クルクミンでは効果が乏しい経口投与でも高い腫瘍抑制能を示しました。この際、マウス個体には副作用の兆候は全く見られませんでした。従って、PGV-1の研究を進めることで、副作用のない抗がん剤の飲み薬を開発することが期待できます。
この成果は、英国時間(夏時間)の2019年10月16日(水)午前10時【プレス解禁日時:日本時間2019年10月16日午後6時】付で Scientific Reports誌のオンライン版に掲載されました。
加藤順也教授のコメント

がんの治療には手術が有効ですが、手術ができないケース、がんが再発した場合や、術前・術後において、抗がん剤治療が効果的に用いられています。しかし、抗がん剤には副作用という大きな問題があります。今回、我々が報告した抗がん剤候補化合物PGV-1は、動物実験で全く副作用の兆候が観察されないので、抗がん剤として大変有望な化合物だと考えています。今後、PGV-1を元に研究が進むことで、副作用がない飲み薬としての新しい抗がん剤が完成されることを切に願っています。
【解説】
1.背景と目的
クルクミンは、インドやインドネシアで用いられるスパイスのターメリック(ウコン)の主成分であり、これまでに抗炎症、抗酸化、抗菌、免疫調節、高血糖抑制、抗癌など多くの薬効が報告されています。抗がん作用については既に海外で臨床試験が行われており一部薬効が認められていますが、作用機序がはっきりせず、高い投与量が必要であることなどから、その有用性についての疑問が残っていました。
これまで我々はクルクミンと相互作用して阻害されるタンパク質を網羅的に調べ、細胞毒である一連の活性酸素種 ( ROS ) を消す代謝酵素群を同定しました。クルクミンで処理した癌細胞では、この代謝酵素の阻害によりROS濃度が上昇すること、抗酸化剤でROSを減少させるとクルクミンによるがん細胞増殖抑制が中和されることなどから、クルクミンによる抗がん作用はROSを介することを明らかにしました(既にScientific Reports誌に発表済み。Curcumin targets multiple enzymes involved in the ROS metabolic pathway to suppress tumor cell growth. Yonika Arum Larasati, Noriko Yoneda-Kato, Ikuko Nakamae, Takashi Yokoyama, Edy Meiyanto, and Jun-ya Kato. Sci. Rep. volume 8, Article number: 2039 (2018), doi:10.1038/s41598-018-20179-6)。
しかし、クルクミンの抗がん作用には高い投与量が必要で実用には不向きです。そこで、(1) ROSを介した抗がん作用が増強する、(2) 正常細胞に対する影響が少なく副作用が認められない、の2点を指標にクルクミン関連化合物ライブラリーをもとに選抜し、極めて優れた抗がん作用を持つ新規化合物PGV-1を得ました。現在、PGV-1のがん細胞増殖抑制能力、動物実験における抗腫瘍活性、動物個体における副作用の有無などについて研究を進めており、副作用のない抗がん剤の飲み薬を開発することが最終目的です。
2.研究成果
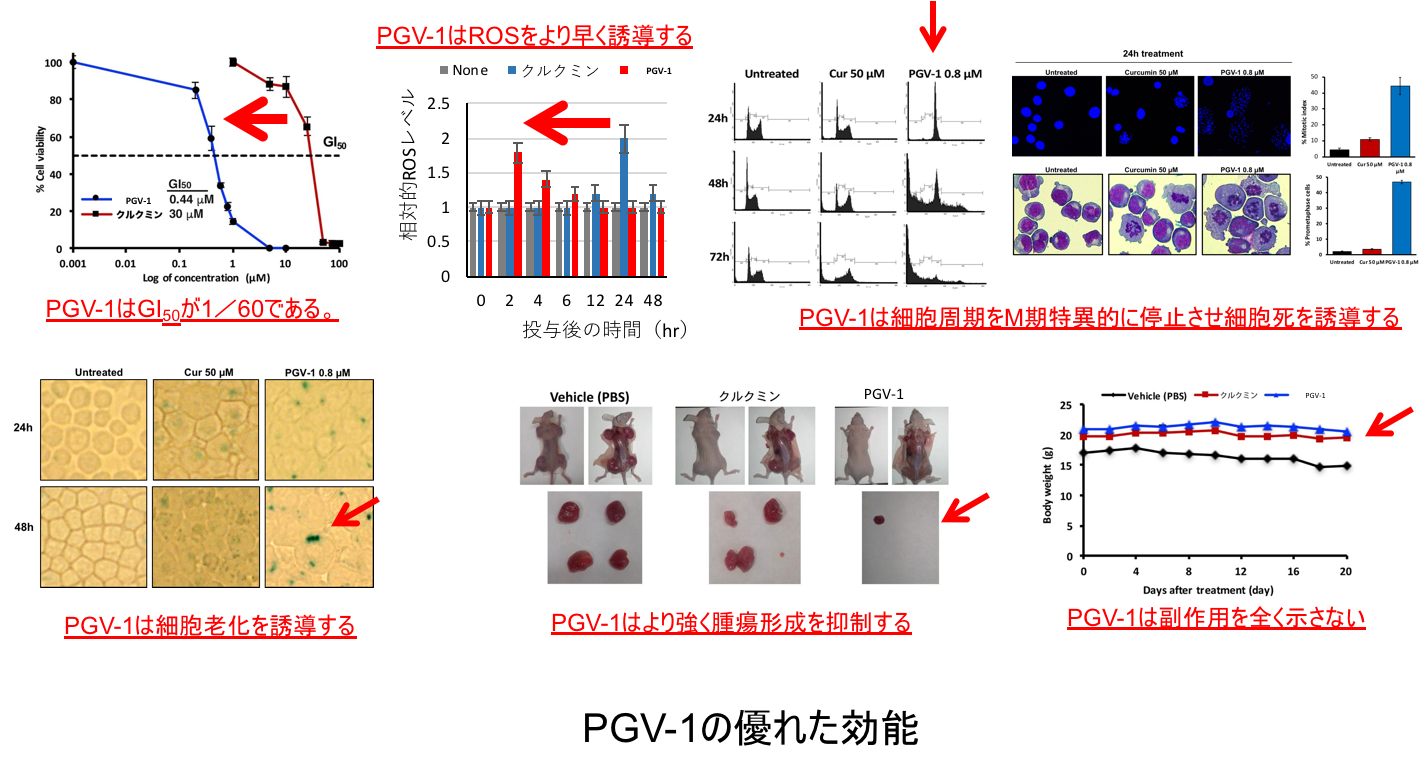
PGV-1のがん細胞増殖抑制能力、動物実験における抗腫瘍活性、動物個体における副作用の有無などについての研究成果は、以下の通りです(下図「PGV-1の優れた効能」参照)。
・試験管内(in vitro)のがん細胞培養実験にてPGV-1はクルクミンと比べて1/60以下のGI50(培養細胞の50%が阻害される濃度)を示しました。つまり60倍以上の増殖抑制効果があったのです。
・PGV-1はクルクミンと比べて10倍早くROSを上昇させました。
・PGV-1はクルクミンと比べてより特異的に細胞周期をM期(前中期)の段階で停止させて、細胞死に陥らせました。
・PGV-1はクルクミンよりも効率よく細胞老化を誘導しました。
・マウスを用いた生体内(in vivo)の実験系にてPGV-1はクルクミンと比べてより強く腫瘍形成を抑制しました。
・PGV-1は経口投与で強く腫瘍形成を抑制しました(クルクミンは経口投与では効果が乏しいことが知られています)。
・PGV-1はマウスに対し全く副作用の兆候を示しませんでした。
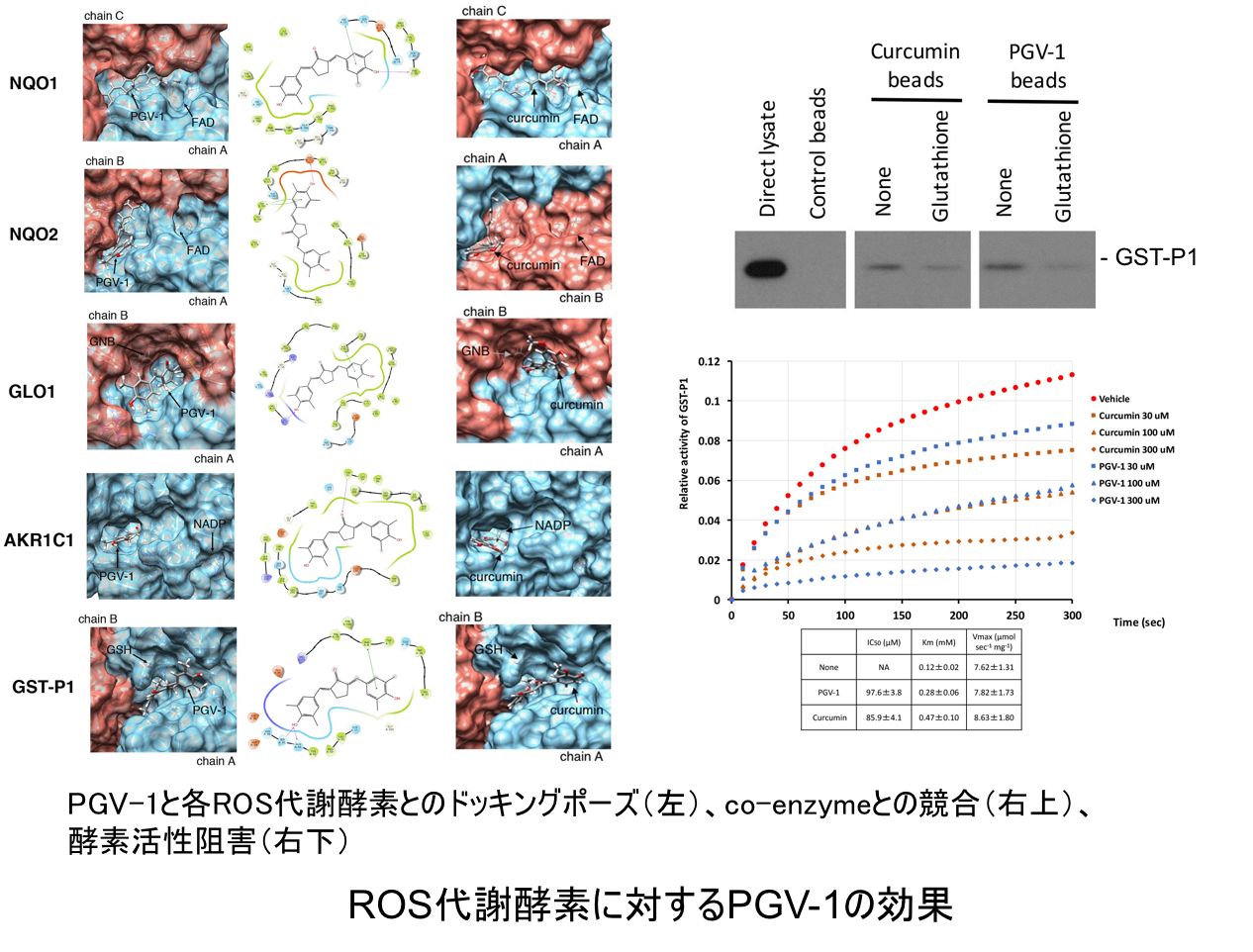
また、PGV-1の作用機序を明らかにする目的で、ROS代謝酵素群との結合のシミュレーション(分子ドッキング法)、タンパク質相互作用解析(プルダウンアッセイ)、酵素活性測定を行い、PGV-1はROS代謝酵素群と直接結合しコエンザイム(酵素を活性化する物質、助酵素)との結合を競合的に阻害することで代謝酵素の活性を阻害することを明らかにしました(下図「ROS代謝酵素に対するPGV-1の効果」参照)。
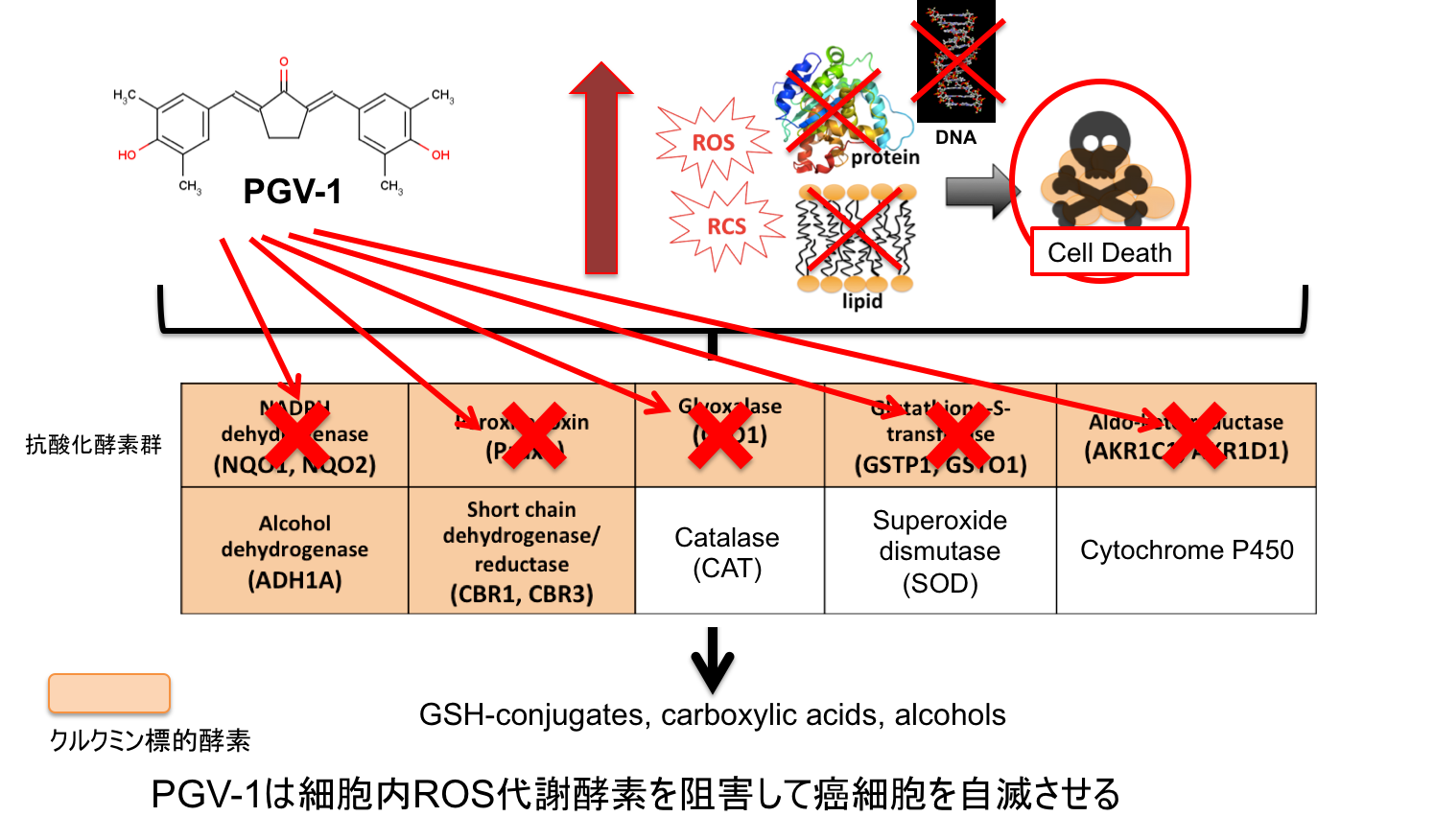
従って、PGV-1はROSを消す抗酸化酵素群の中でもがん細胞で働きが強いROS代謝酵素群を標的にすることで、がん細胞特異的に細胞内ROSレベルを上昇させ、がん細胞を死に追いやることがわかりました(下図「PGV-1は細胞内ROS代謝酵素を阻害して癌細胞を自滅させる」参照)。
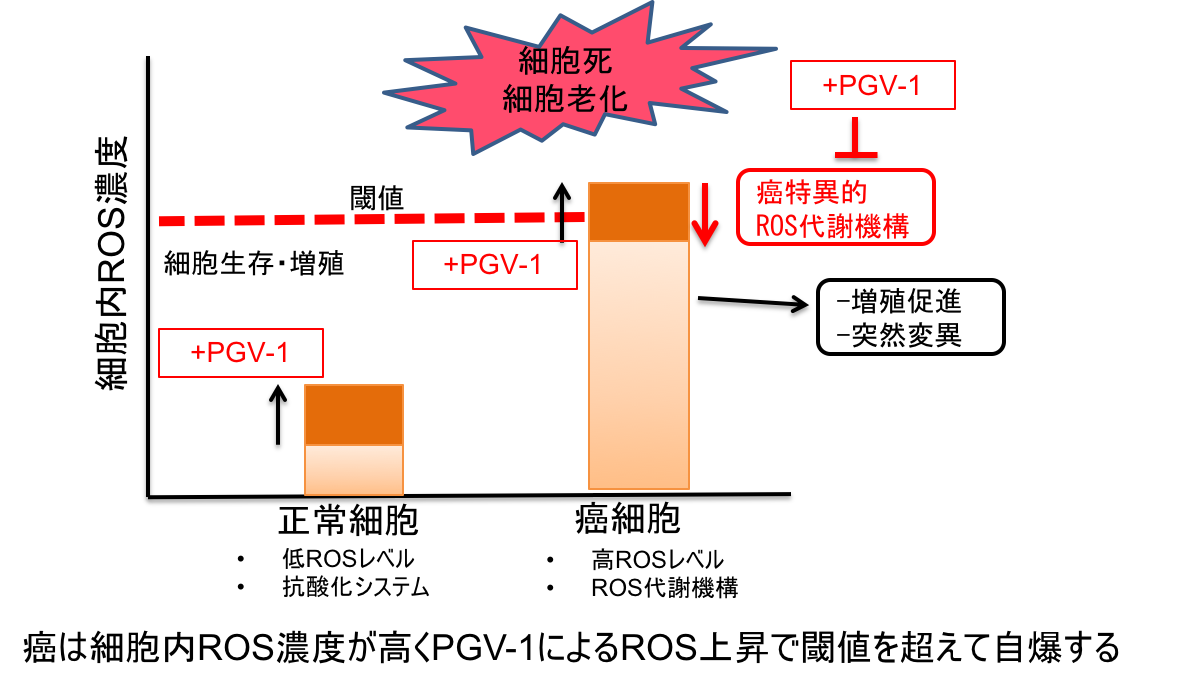
近年、様々な種類のがん細胞内でROSレベルが高いことが報告され、これを標的にすることでがん特異的な(副作用が少ない)治療法に繋げる研究が進んでいます。正常細胞では元々のROSレベルが低いのでPGV-1によりROSレベルが少し上昇しても問題はないが、癌細胞は高めのROSレベルを増殖促進や突然変異に利用しているのでPGV-1によりさらにROSレベルが上昇すると許容閾値レベルを超えてしまい、その結果、細胞老化や細胞死を引き起こして自滅に陥るのです(下図「癌は細胞内ROS濃度が高くPGV-1によるROS上昇で閾値を超えて自爆する」参照)。実際、PGV-1はマウスに対し全く副作用の兆候を示さなかったことからも、PGV-1が癌細胞特異的に働いていることがわかります。
3.今後の展開
本研究の結果からPGV-1はクルクミンと比べて60倍以上に増殖抑制能力が強化され動物実験では経口投与でも高い腫瘍抑制能を示すにも関わらず副作用の兆候を全く示しませんでした。従って、PGV-1を元に研究を進めることで、副作用なく、飲み薬として使えるという、従来には存在しない新規の抗がん剤を開発することが期待できます。目標とする抗がん剤は副作用が少ないことが期待できるので、従来の化学療法に置き換えての使用や、あるいは既存薬との併用効果も期待できます。手術前の寛解に向けた投与や、術後の再発防止のための投与に加えて、普段での生活における予防薬としてのサプリメントとしての開発も考えられ、強い副作用のために治療を断念していたケースでの利用も視野に入れることができます。さらに、ROS代謝酵素など標的酵素の発現レベルをがん組織で調べることにより、その薬効を投与前に判断しうる診断バイオマーカーも合わせて設定することも可能になります。
【用語解説】
活性酸素種(ROS: Reactive Oxygen Species):
酸素分子(O2)に由来し反応性に富む分子群の総称を言います。ROSはミトコンドリアの電子伝達系における副産物として、あるいは細胞質ではNOXなどの酵素により生成されます。生体内では、様々な抗酸化酵素や抗酸化物質により代謝されるのですが、過度のROSは生体内物質(核酸、蛋白質、脂質)を損傷し酸化ストレス応答を誘導することで細胞老化や細胞死を引き起こします。
【原著論文】
https://www.nature.com/articles/s41598-019-51244-3
【腫瘍細胞生物学研究室】
研究室紹介ページ:https://bsw3.naist.jp/courses/courses208.html
研究室ホームページ:https://bsw3.naist.jp/kato/
(2019年10月30日掲載)
 奈良先端科学技術大学院大学
奈良先端科学技術大学院大学