悪玉菌の増殖を抑え、腸内細菌をIgA抗体で制御 ~腸内細菌叢改善薬の開発に道~
悪玉菌の増殖を抑え、腸内細菌をIgA抗体で制御 ~腸内細菌叢改善薬の開発に道~
バイオサイエンス研究科応用免疫学研究室 新藏礼子(しんくら れいこ)教授らの研究グループは、炎症性腸疾患などで免疫系が過剰刺激を受けて炎症を起こす原因が腸内細菌叢の変化であると考えた。研究グループはマウスの腸から多くのIgA(イムノグロブリンA)抗体を分離し、その中で多くの種類の腸内細菌に一番強く結合するW27IgA抗体(W27抗体)を選択した。腸炎を起こすモデルマウスに、W27抗体を経口投与すると、腸内細菌叢が変化し、腸炎を抑制する効果があることを突き止めた。W27抗体は細菌のある特定のアミノ酸配列を持つ代謝酵素を識別して結合することにより、増殖を抑制すべき細菌を見分けていることも明らかにした。興味深いのは、W27抗体が攻撃するのは大腸菌など悪玉菌の仲間で、W27抗体が認識しないのは乳酸菌やビフィズス菌といったいわゆる善玉菌ということである。悪い菌の増殖を抑制して、良い菌の増殖を妨げないので、全体として良い菌が優位になる腸内環境へと変化する効果が見られた。
W27抗体が悪玉菌の増殖を抑えることを明らかにした本研究成果は、腸内細菌叢を改善して、腸炎だけではなく種々の病気の予防や治療にもつながることが期待される。
この研究成果は、英国(ロンドン)時間の7月4日(月)午後4時【プレス解禁日時:日本時間平成28年7月5日(火)午前0時】付けで、Nature Microbiologyのオンライン版に掲載された。
新藏 礼子教授コメント
今回の研究成果の詳しい内容はプレスリリースの資料をご覧ください。ここでは、この研究の来し方についてお伝えしたいと思います。
思い出すのは5年半ほど前、前任校である長浜バイオ大学の私の空っぽの研究室に学部3回生だった岡井くんが卒研生として来てくれた頃のことです。今回の研究のアイデアはすでに私の頭の中にありましたが、マウスの腸管からハイブリドーマを作ることはかなりハードルの高い仕事であることを承知していましたので、さて学部生にできるかしら?と思っていました。実際、その当時、腸管からハイブリドーマを作るという研究計画を申請書に書くと、実現不可能である、というコメントとともに不採択通知ばかりが戻ってくる状態でした。ハイブリドーマの仕事は大変だけどきっと面白い結果がでると思うよ!と岡井くんを誘い、(本人いわく半ば騙されて?)実験が始まりました。今回の論文に発表した腸管IgA抗体の親玉みたいなW27抗体は岡井くんが行った最初の実験でクローニングされた抗体です。予想した通り、腸管から取り出したIgA抗体のほとんどは多くの種類の細菌に結合しました。W27抗体は細菌への結合力が一番強い抗体として選びました。それだけではなく、W27抗体は乳酸菌やビフィズス菌のような善玉菌にはほとんど結合しなかったのです。この結果を私はまったく予想もしていませんでした。IgA抗体がすべての腸内細菌を同じ様に認識して結合すると善玉菌も抑制されるかもしれないし困るなあと考えていたので、願ってもない抗体が取れたことに心底驚きました。その後、岡井くんはハイブリドーマを山ほど作りましたがW27より優れた抗体はありません。
岡井くんより一年遅れで臼井文人君が研究室に加わってくれました。学部3回生の忘年会の席で、就職するか進学するか迷っていた臼井君に、迷うなら大学院に行きなさい!と喝を入れたことを今でもよく覚えています。臼井君はW27抗体が認識する細菌の分子を特定することをテーマにしました。W27抗体が認識するスポットを2次元電気泳動のゲルから切り出し質量分析を行いました。結果は何度繰り返してもセリンヒドロキシメチルトランスフェラーゼという代謝酵素が出てきました。しかし、抗体が認識する分子は細胞表面にある膜たんぱく質に違いないという先入観を私が持っていたため、膜たんぱく質がリストに出て来るまで臼井君は実験を繰り返すしかありませんでした。結果は論文に示す様にこの酵素がターゲットであったわけで、自分の頭の固さを大いに反省しました。
先入観に左右されない純粋な気持ちで二人が丁寧に実験を続けてくれた結果がやっとまとまりました。研究はまだ途中ですが、若い力は研究の大きな原動力になります。下記に岡井君と臼井君のコメントがありますが、いつ終わりが来るかわからない研究でも地道に継続することが重要だと思います。二人の持続力を讃えたいと思います。

岡井 晋作君コメント (写真右下)
今回Nature Microbiologyに研究成果を発表することができましたのは、新藏礼子教授をはじめとする多くの共同研究者の皆様の御協力のおかげです。この場をお借りし深く御礼申し上げます。
自分自身、研究を行っていく中で結果が出るまで同じ実験を何度も繰り返し行い結果が出ずに諦めかけたこともありましたが、粘り強く実験を行った結果、今回の研究成果に繋げることができました。
この研究成果を励みに今後さらに、研究を発展していけるように日々精進していきたいと思います。
臼井 文人君コメント (写真左下)
この度、論文がNature Microbiologyに掲載されることになりました。
初めて論文を発表するわけですが、論文一本を掲載して頂くことがこれほど大変なことだとは思っていませんでした。いくつかの雑誌に論文を投稿し、その度に文章や図の大幅な修正を幾度も繰り返しました。またアクセプトされた後にも、文章と図の微修正と確認を何度も行いました。修正と確認の繰り返しが嫌になることもありましたが、このような大変な思いをしたからこそ、論文が掲載されることを非常に嬉しく思っております。
【概要】
バイオサイエンス研究科応用免疫学研究室 新藏礼子(しんくら れいこ)教授らの研究グループは、炎症性腸疾患などで免疫系が過剰刺激を受けて炎症を起こす原因が腸内細菌叢の変化であると考えた。研究グループはマウスの腸から多くのIgA(イムノグロブリンA)抗体を分離し、その中で多くの種類の腸内細菌に一番強く結合するW27IgA抗体(W27抗体)を選択した。腸炎を起こすモデルマウスに、W27抗体を経口投与すると、腸内細菌叢が変化し、腸炎を抑制する効果があることを突き止めた。W27抗体は細菌のある特定のアミノ酸配列を持つ代謝酵素を識別して結合することにより、増殖を抑制すべき細菌を見分けていることも明らかにした。興味深いのは、W27抗体が攻撃するのは大腸菌など悪玉菌の仲間で、W27抗体が認識しないのは乳酸菌やビフィズス菌といったいわゆる善玉菌ということである。悪い菌の増殖を抑制して、良い菌の増殖を妨げないので、全体として良い菌が優位になる腸内環境へと変化する効果が見られた。
W27抗体が悪玉菌の増殖を抑えることを明らかにした本研究成果は、腸内細菌叢を改善して、腸炎だけではなく種々の病気の予防や治療にもつながることが期待される。
【解説 】
抗体のクラススイッチによる多様化(※3)は正常に起こるものの、抗原に対する結合力を増すための体細胞突然変異が障害されているマウス(AIDG23Sマウス)の病態解析から、細菌に強く結合するIgA抗体を産生できないと腸内細菌の異常増殖や腸炎が発症することを明らかにした1)2)。この病態の治療には野生型マウス由来の多種類の腸内細菌に強い結合力を持つIgA抗体を経口で補充することが有効ではないかと考え、野生型マウスの腸管 IgAから多くの腸内細菌に最も高い結合力を示したW27抗体を選択した。W27抗体は大腸菌に強く結合したが、乳酸菌やビフィズス菌のようないわゆる善玉菌にはほとんど結合しなかった。つまり、W27抗体は善玉菌と悪玉菌を識別する抗体であることがわかった。W27抗体は細菌の増殖にかかわる代謝酵素(セリンヒドロキシメチルトランスフェラーゼ)のある一部分のアミノ酸の違いを識別して、各細菌への結合力が異なることも明らかにした。さらにW27抗体は強く結合する大腸菌の増殖を抑制したが、ほとんど結合しない乳酸菌の増殖は抑制しなかった(図1)。すなわち、悪玉菌を識別して結合しその増殖を抑え、一方で善玉菌には結合しないため善玉菌の増殖を阻害しないことがわかった。

図1(左図)W27抗体が認識する抗原分子はいろいろな細菌が持っているが、それぞれの細菌の分子の形が異なることをW27抗体は識別するため、善玉菌を攻撃せず悪玉菌だけを攻撃する。(右図)実際にW27抗体と細菌を混合して培養すると、大腸菌の増殖が抑えられたが乳酸菌の増殖は影響を受けなかった。mIgAはどちらの細菌にも結合しない抗体である。
一方、W27抗体を腸炎マウスに経口投与すると、腸内細菌叢のバランスが変化し、大腸の組織が改善した(図2)。
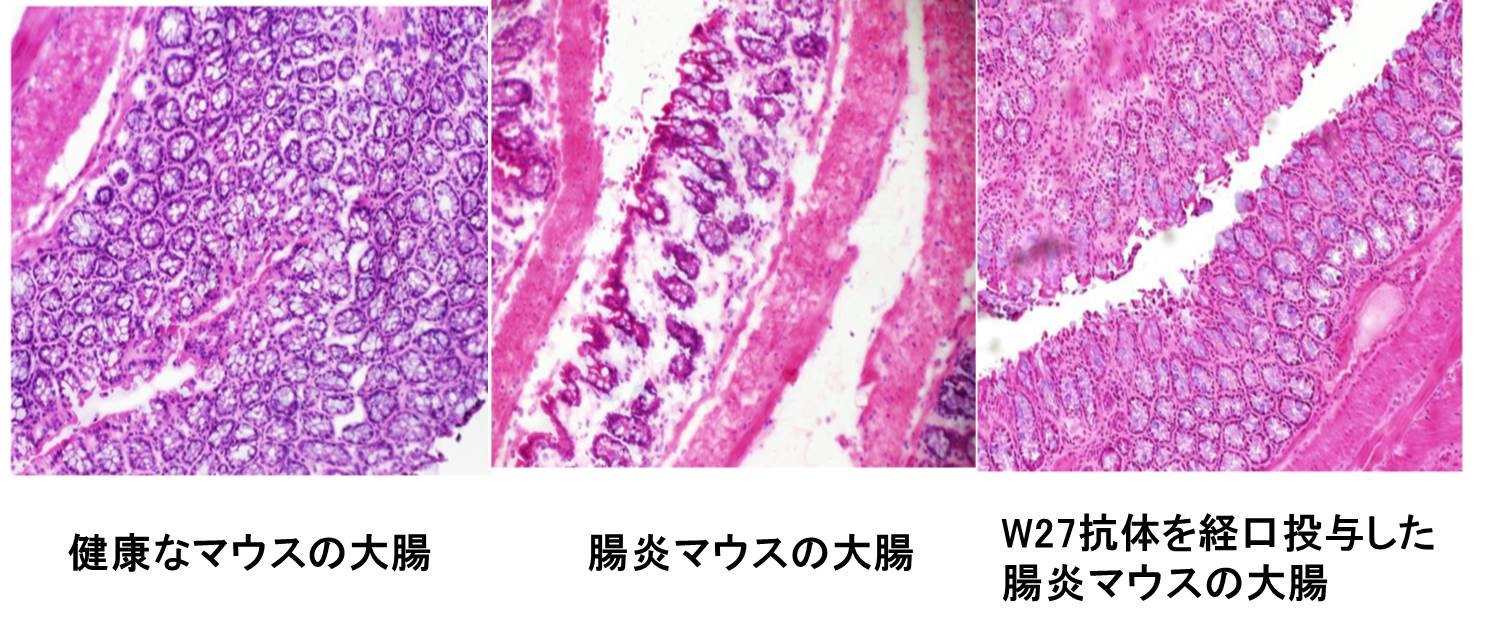
図2 W27抗体を経口投与された腸炎マウスの大腸組織は健康なマウスと同じになった。
さらにW27抗体を他の腸炎モデルマウス(DSS誘導性腸炎(※4)、およびT細胞移入腸炎(※5))に経口投与すると、腸内細菌叢が変化して体重減少が少なくなり、腸炎が抑制された。(図3)

図3 DSS腸炎とT細胞移入腸炎モデルにおけるW27抗体経口投与の体重減少抑制効果
W27抗体を飲み水にまぜて4週間投与した。2つの腸炎モデルにおいて体重減少率を腸炎抑制効果として評価した。2つのモデルにおいてW27抗体経口投与により、有意にマウスの体重減少が抑制された。大腸組織の損傷も軽度であった。
これらの結果から、W27抗体は腸内細菌制御に有効な経口治療薬候補であることに加え、マウスにおいて細菌との相互作用の鍵としてセリンヒドロキシメチルトランスフェラーゼを認識することを明らかにした。今後、ヒトへの応用のための基礎研究を行うことで、IgA抗体を腸内細菌叢改善薬として開発する合理的な可能性を示し、医薬品開発への原動力としたい。
【国内外の類似研究との比較と、研究開発の独創性・新規性 】
1)他の競合技術との比較
a) 健常人便移植、細菌移植との比較
決まった質の製品を工場で生産することが難しい。
b) 抗炎症剤、免疫抑制剤、抗生剤との比較
長期の抗炎症剤や免疫抑制剤の投与は、全身の免疫抑制や骨髄抑制など副作用が大きい。抗生剤投与は、腸内細菌叢全体を抑制するのでいわゆる善玉菌も減少してしまう。
どの菌が悪玉菌であるかも不明な状況で、悪玉菌にのみ作用するW27抗体のような選択性を持った抗生剤を開発することは難しい。
2)本研究の優位性
W27抗体は腸内細菌叢への介入を作用点とする初めての抗体医薬品候補である。腸内細菌叢の選択的制御を通して適切な腸内細菌叢の再建を導く可能性が高い
経口投与で効果が得られれば、静注に比べて副作用を最低限に抑えられる。
3)研究開発の将来展望
世界初の経口用モノクローナルIgA抗体の炎症性腸疾患治療薬開発を目指す。炎症の治療薬ではなく、腸内細菌叢を改善して根治を目指す。
また、本研究を発展させることでW27抗体がターゲットとする細菌群、あるいは腸内細菌叢構成を定義できれば、便(腸内細菌)の解析をするだけでどのような患者がIgA抗体の経口投与の対象としてふさわしいかを定義できる。言い換えると、治療の効果を予想し判定することが可能になり、高価な抗体医薬を有効に活用することができる。
【参考文献】
1) Wei M*, Shinkura R*, et al.
(*equal contributors) Nat Immunol. Mar;12(3):264-70, 2011
2) Shinkura R, et al. Nat
Immunol 5(7), 707-712, 2004
【発表論文】
タイトル:High-affinity monoclonal IgA regulates gut
microbiota and prevents colitis in mice.
著者:Okai S, Usui F, Yokota S, Hori-I Y, Hasegawa M, Nakamura T,
Kurosawa M, Okada S, Yamamoto K, Nishiyama E, Mori H, Yamada T, Kurokawa K,
Matsumoto S, Nanno M, Naito T, Watanabe Y, Kato T, Miyauchi E, Ohno H, Shinkura
R.(下線は共同第一著者)
掲載誌:Nature Microbiology,
【本研究について】
本研究は、長浜バイオ大学、理化学研究所(横浜)、東京工業大学、ヤクルト中央研究所、熊本大学、奈良先端科学技術大学院大学との共同研究によるものであ
る。また、科学技術振興機構(JST) 戦略的創造研究推進事業 および日本学術振興会の科学研究費の一環で実施した研究成果である。
本研究成果は主研究者である新藏礼子が本年3月まで在籍した長浜バイオ大学で上記の共同研究と支援を受けて行った。今後は4月から在籍する奈良先端科学技術大学院大学において、抗体医薬の実用化につながる研究を継続する。
【用語解説】
※1)腸内細菌叢:ヒトなどの腸管内には多種多様な細菌が集まって複雑な生態系を構築しており、この微生物群集全体を腸内細菌叢と呼ぶ。
※2)W27 IgA抗体:健康なマウスの小腸で産生される多種類のIgA抗体の中の1つの種類。多くの種類の腸内細菌に一番強く結合するIgA抗体として選択された。
※3)クラススイッチによる多様化:抗体には生物活性の異なる5つの種類(IgM, IgD, IgG, IgE, IgA)があり、これをクラスと呼ぶ。抗体を産生する細胞は初めに必ずIgMを産生する。抗原に出合って刺激されると遺伝子組換えを起こしてIgGなどのIgM以外のクラスの抗体を産生するようになる。これをクラススイッチと呼ぶ。クラスが変わることで病原菌などを攻撃する活性が多様化する。
※4)DSS誘導性腸炎:デキストラン硫酸ナトリウム(DSS)をマウスに飲ませることで腸粘膜上皮細胞の障害を誘導し、下痢、下血、体重減少などヒトの潰瘍性大腸炎と類似の症状を引き起こす。
※5)T細胞移入腸炎:リンパ球を持たないマウスにナイーブT細胞を移入するとヒトの潰瘍性大腸炎と類似の症状を引き起こす。
【応用免疫学】
研究室紹介ページ:http://bsw3.naist.jp/courses/courses213.html
(2016年07月08日掲載)
 奈良先端科学技術大学院大学
奈良先端科学技術大学院大学