mRNA転写の効率化
概要
遺伝子の発現において重要な過程の一つがDNAからmRNAへの転写です。この過程は、転写の開始に関わるプロモーターや、転写の終結に関わるターミネーター、mRNAの成熟化に関わるスプライシングなど複数の要因によって制御されており、細胞の状態に応じて転写されるmRNAの量や塩基配列を決定しています。我々はこの転写およびmRNAの成熟化に関する研究を行うことで、導入遺伝子高発現系における転写されるmRNA量の増加や転写されるmRNAの配列の均一化を行っています。
導入遺伝子高発現系に適したコアプロモーター配列の設計
転写の開始には、ゲノム上に存在するプロモーターと呼ばれる領域が必要です。さらに、このプロモーターは機能的な観点から、転写される量(転写効率)やタイミングを調節するエンハンサー等の領域と、基本的な転写効率と転写開始点を決定するコアプロモーターに分けることができます(図1A *1)。一般的に、導入遺伝子を高発現させるためにプロモーターを改変する場合、エンハンサーを対象とすることが多く、コアプロモーターにはあまり注意が払われていません。これは、転写効率には主にエンハンサーが重要であると考えられていたためですが、近年の研究によってコアプロモーターも転写効率に無視できないほど大きな影響を持つことが分かってきました。つまり、エンハンサーだけではなく、コアプロモーターも改良することによって従来の高発現プロモーターを更に効率化できる可能性があります。加えて、コアプロモーターは転写開始点を決定することで、転写されるmRNAの配列を決定します。導入遺伝子高発現系を最適化していく場合、1塩基のずれもなく意図した通りにmRNAが転写される必要がありますが、コアプロモーターの配列によっては、転写開始点が複数に分散し、意図したものとは異なるmRNAが一定の比率で転写されています。従来の高発現プロモーターでは、このように高度な設計が施されることを想定していないため、転写開始点の分散には注意が払われていません。そのため、そもそも分散型のプロモーターを使用している場合や、本来は収束型であるにも関わらず、発現カセットの操作を行う際に、適切なコアプロモーターを破壊してしまった場合などでは、転写開始点の分散や発現能力の低下が生じます(図2B)。発現能力を高め、高度な設計に対応するためには、コアプロモーターを改良し、適切に発現カセットを設計するためのノウハウを確立する必要があります。
当研究室ではこれまでに、Cap Analysis of Gene Expression(CAGE)と呼ばれる手法を用いた網羅的な転写開始点の同定を、様々な生物種の様々な条件で行ってきました。現在は、そうして得られた膨大なデータを基に、転写効率が高く、転写開始点が1塩基単位で厳密に収束しているコアプロモーターに共通する配列的な特徴を解析しています。そして、得られたデータ解析結果を基に、導入遺伝子高発現系に適したコアプロモーター配列の設計を行っています。
*1 プロモーターは、core promoter、proximal promoter、distal promoterと呼ばれる3つの領域に分けることができます。エンハンサーやサイレンサーは、コアプロモーターに近いproximal promoterに含まれている場合や、それよりも遠くに存在しdistal promoterとされる場合などがあります(distal promoterとはエンハンサーやサイレンサーの別名です)。植物など、エンハンサー領域がコアプロモーターの上流1000塩基以内に存在していることが多い場合では、エンハンサー領域も含めてプロモーターと呼称することが多いです。しかし、哺乳動物のように、エンハンサー領域がコアプロモーターから数kbp以上も離れているような場合では、一般的にプロモーターとはcore promoterおよびproximal promoterを指し、エンハンサー領域とは区別されることが多いです。
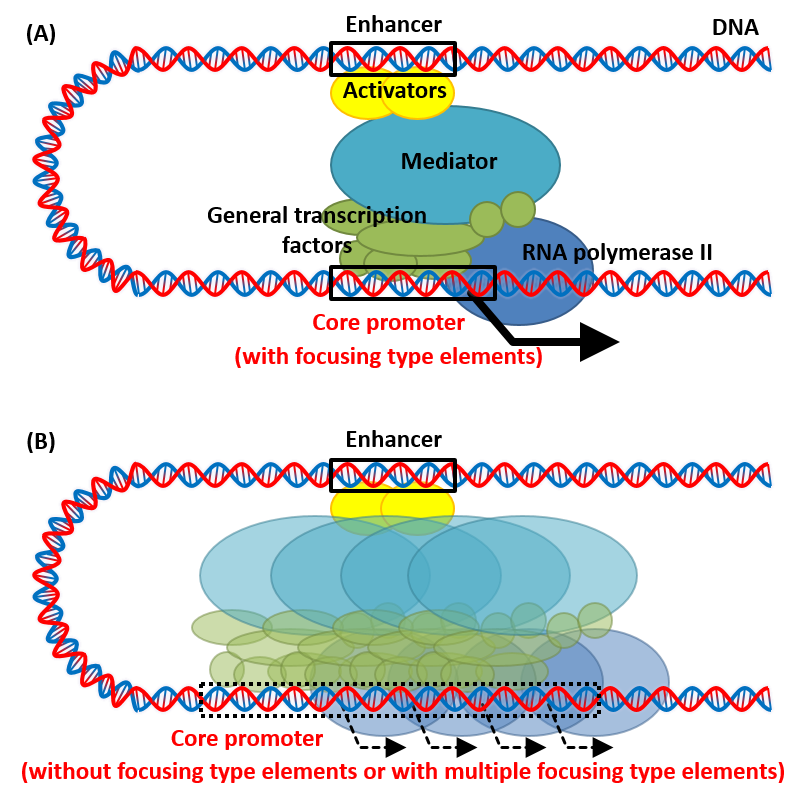
図1 コアプロモーターと転写の開始
(A)1点から収束して転写が開始される場合の模式図。TATA-boxに代表されるような転写開始点の収束に関係する複数のコアプロモーター要素がコアプロモーター内の1か所に確かに存在している場合、基本転写因子群はその1点と強く結びつくため、転写開始点も1点に収束します。(B)複数の転写開始点に分散して転写される場合の模式図。収束に関わるコアプロモーター要素を持たない場合や、複数個所に収束に関わるコアプロモーター要素が存在してる場合などでは、基本転写因子群が結合する位置が1か所に限定されないため、認識されうる様々な位置から転写が行われます。内在性遺伝子の多くは、このような分散型のコアプロモーターです。
効率的なターミネーターの探索
転写の開始に関わるプロモーターと対をなすのが、転写の終結に関わるターミネーターです。mRNAの成熟化と転写終結を概説すると、まず、RNAポリメラーゼIIにより転写されたpre-mRNA上のシス配列(ポリAシグナル等、ターミネーターに相当する領域に存在)をプロセッシングに関わるタンパク質因子群が認識し、切断します(図2A)。その後、タンパク質因子群に含まれるポリAポリメラーゼにより切断部位へポリA鎖が付加されます。もし、シス配列が不適切な場合は、これらタンパク質因子群が適切に認識できず、ポリA付加部位の分散や、pre-mRNAからmRNAへの変換効率の低下、転写が終結しないことによる下流へリードスルー(異常RNAの転写)などが生じます(図2B)。これにより、自身の転写効率が低下するだけでなく、下流の転写単位への新たなRNAポリメラーゼIIの接近が阻害することで、下流遺伝子の転写も阻害します(転写干渉)。
現在、植物で広く用いられているターミネーターは、アグロバクテリウム由来のNOS(ノパリン合成酵素遺伝子)ターミネーターですが、このNOSターミネーターには明瞭なシス配列が存在せず(実のところ植物ではこのシス配列について詳細は解っていません)、ポリA付加部位も広く分散しています。また、NOSターミネーターを用いた場合、上記の転写干渉が観察されることから(NOSターミネーターの利用がサイレンシングの一つの要因とも考えられます)、実は効率が非常に悪いターミネーターと言えます。
我々は、NOSターミネーターに代わる効率的なターミネーターをシロイヌナズナより探索し、HSP18.2遺伝子由来のターミネーターが非常に有用であることを見出しました。レポーター遺伝子の発現を指標に、HSPターミネーターの能力をNOSターミネーターと比較すると、約2倍の発現上昇が認められます(一過性発現実験による検証)。また、HSPターミネーターを用いた場合には、転写干渉も緩和されます。現在、このHSPターミネーターは、多くの研究機関/企業において種々の植物種で外来遺伝子発現に活用されています。また、HSPターミネーターのより長い領域を用いると(HSPT878:878 bp、核マトリクスと相互作用すると思われる領域を含む)、一過性発現実験では同等の発現レベルですが、核ゲノムへ挿入した場合に更なる発現上昇が期待できます。このHSPターミネーターは、植物での効率的な発現カセットの一部として商品化されており、タカラバイオ社からpRI201 DNAシリーズとして市販されています。(リンク)
加えて、近年登場した技術を用いることで、ポリA付加部位を網羅的に評価することが可能となりました。現在、Nanoporeシーケンサーと呼ばれるロングリードシーケンサーを用いることで、ポリA付加部位の網羅的なデータを取得しており、より効率的なターミネーター配列を設計するための研究を行っています。
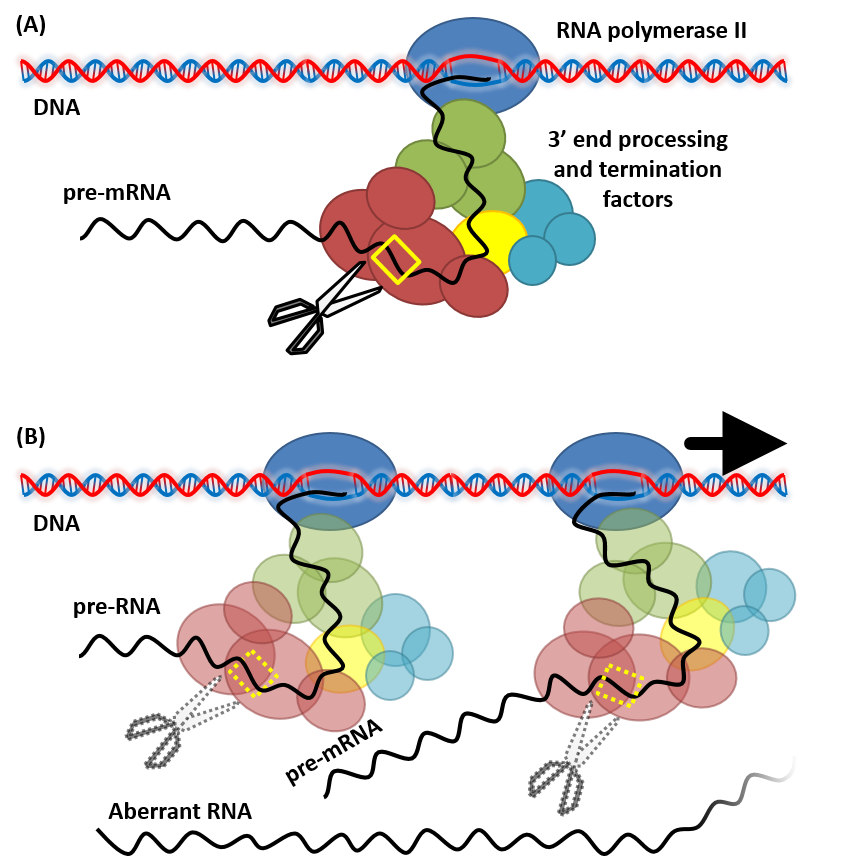
図2 ターミネーターと転写の終結
(A)効率的な転写終結の模式図。転写の終結に関わる要素がターミネーター上に確かに存在している場合、その配列がpre-mRNAとして転写され、プロセシングと転写終結に関わる因子に認識される転写終結のプロセスが開始されます。(B)非効率的な転写終結の模式図。転写の終結に関わる確かな要素がターミネーター上に存在しない場合、複数の箇所での非効率的な転写終結や、転写が終結せず下流へリードスルーすることによる異常RNAの転写などが生じます。
意図しないスプライシングの抑制
転写では、まずDNAからmRNA前駆体が転写され、5'キャップ、RNAスプライシング、ポリA付加といった修飾を受け成熟mRNAとなります。この中で、スプライシングは、mRNA前駆体から特定の配列(イントロン)を除去し、他の配列(エキソン)をつなぎ合わせる過程であり、mRNAの配列を大きく変えることで、翻訳されるタンパク質の機能にも影響を及ぼしています。つまり、導入した有用遺伝子上で意図しないスプライシングが発生した場合、本来作りたかった有用タンパク質(図3A)とは異なるものができてしまう可能性があります(図3B)。このスプライシングは、5'および3'スプライシングサイトが認識されることで生じ、GU-AGという高度に保存された配列パターンが存在していることが知られています。そのため、導入遺伝子高発現系においてmRNAへと転写される領域の配列を変える際には、意図しないスプライシングサイトが出現しないように注意を払う必要があります。しかし、GU-AGというパターンは単純なため出現頻度も高く、コドンの制限を考慮すると全てを取り除くのは不可能です。また、非常に強い配列改変上の制限を加えることになるため、配列改変の自由度を大きく抑制します。実際には、GU-AG周辺の配列もスプライシングに関わっており、GU-AGのパターンの中には、100%の確率でスプライシングが生じる位置や、20%しか生じない位置、全く生じない位置などが存在しています。我々は、意図しないスプライシングは抑制した上で自由度が高い配列の改変が行えるように、網羅的にスプライシングサイトを同定し、このようなスプライシングサイトとスプライシングが生じる確率の関係性の解析を行っています。
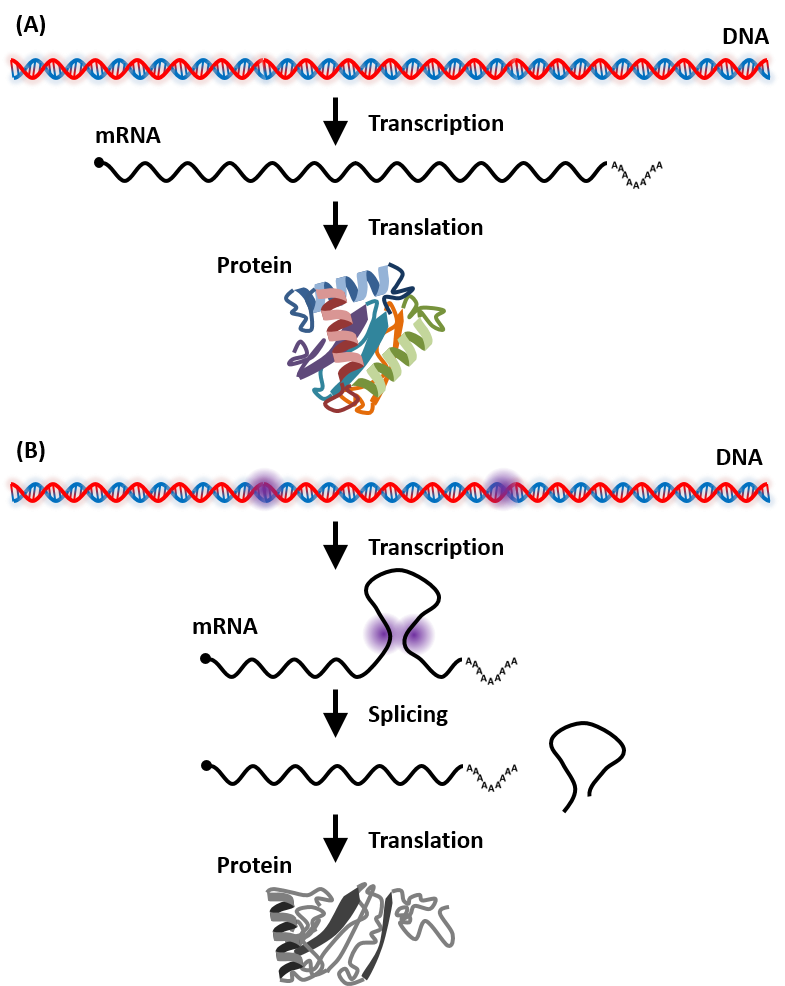
図3 スプライシングの模式図
(A)イントロンを含まない目的遺伝子が発現する過程の模式図。(B)イントロンを含まない目的遺伝子が発現する過程で、意図しないスプライシングが生じ、目的のタンパク質が生産できない場合の模式図。