網膜形成を担う網膜前駆細胞の分化・再生機能を長く維持するための因子を特定
クロマチンの構造変化を制御する酵素が、遺伝子発現を安定化していた
~網膜再生研究への応用に~
網膜形成を担う網膜前駆細胞の分化・再生機能を長く維持するための因子を特定
クロマチンの構造変化を制御する酵素が、遺伝子発現を安定化していた
~網膜再生研究への応用に~
【概要】
奈良先端科学技術大学院大学(学長:塩﨑一裕)先端科学技術研究科 バイオサイエンス領域の松田 泰斗准教授、松田花菜江特任研究員、九州大学(総長:石橋達朗)大学院医学系学府の博士後期課程学生(当時)石龍悠氏、同大学院医学研究院の園田康平教授、村上祐介准教授、中島欽一教授らの研究チームは、網膜の発生期に、神経細胞や視細胞などの細胞に分化する網膜前駆細胞(RPC、注1)の働きを持続させることで、網膜形成に重要な役割を果たす酵素Setd8(注2)を初めて明らかにしました。網膜前駆細胞の働きは、遺伝子DNAの塩基配列の変化ではなく、DNA が巻き付いたタンパク質の複合体(クロマチン)の構造変化により維持するとされており、Setd8は、このエピジェネティック(後天的)な変化を起こすタンパク質の化学修飾を制御しています。このため、病気などで失われた網膜を再生する研究にもつながると期待されます。
私たちの目の網膜は、発生期には「網膜前駆細胞」と呼ばれる幹細胞様の細胞から作られます。興味深いことに、ゼブラフィッシュなどの魚類では、成体になっても網膜が損傷を受けると、支持細胞であるミュラーグリアが再び前駆細胞様の状態へと変化し、網膜が損傷しても再生できることが知られています。一方、マウスを含む哺乳類では、発生が進むにつれて網膜前駆細胞は失われ、損傷後もこのような再プログラムはほとんど起こらないため、網膜の再生能力は極めて限られます。もし「前駆細胞らしさ(前駆細胞性)」を維持する分子メカニズムを解明できれば、成体の網膜細胞に再び前駆細胞性を付与し、失われた網膜機能を回復させることができるようになる可能性があります。この前駆細胞らしさの維持には遺伝子発現と、それを厳密に制御するクロマチンの開閉状態(注3)の設計(エピゲノム、注4)が重要と考えられてきましたが、具体的な維持因子は特定されていませんでした。
本研究では、マウス発生過程の網膜前駆細胞を単離し、遺伝子発現とクロマチン構造を同時に解析(マルチオミクス解析)しました。その結果、網膜前駆細胞では発生後期まで特有のクロマチン状態と遺伝子発現が維持されており、その維持にヒストン修飾酵素Setd8が重要であることを明らかにしました。さらにSetd8の機能が失われると、前駆細胞の増殖低下や細胞死が起こり、分化細胞数の減少と網膜層の菲薄(ひはく)化が生じることがわかりました。
これらの結果から、Setd8は、網膜前駆細胞が「前駆細胞であり続ける」ためのクロマチン構造を維持し、正常な網膜発生を支える重要因子であることが示されました。本研究は、網膜発生の分子基盤の理解を深めるとともに、将来的な網膜再生研究への応用が期待されます。本研究成果は、国際学術誌「Stem Cell Reports」に 2026 年 1 月 29 日(木)午前 11 時(米国東部時間)に公開されました (DOI:10.1016/j.stemcr.2025.102789)。
【背景と目的】
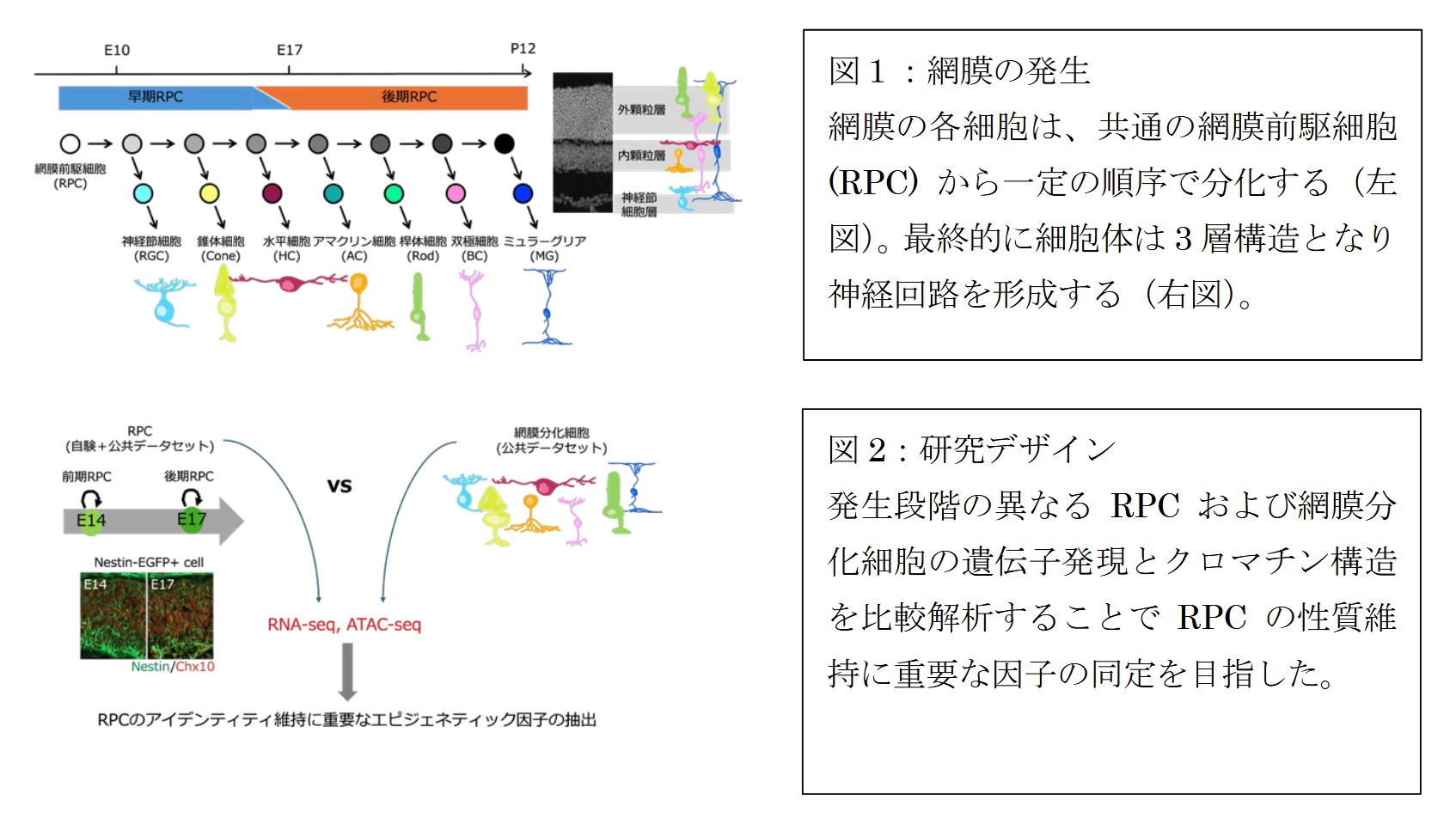
網膜は視覚情報をつくる中枢神経組織であり、胎生期(妊娠期間)から、出生直後までの期間に網膜前駆細胞(RPC)から視細胞や神経細胞、ミュラーグリア細胞など多様な細胞が順序立てて生み出されることで形成されます (図1)。マウスを含む哺乳類では、発生が進むにつれてRPCが減少し、 最終的にミュラーグリア細胞へと分化します。ミュラーグリア細胞はRPCと一部の遺伝子発現が似ていますが、成体網膜では神経新生能(神経細胞を生み出す力)をほとんど示さないため、マウス成体網膜の再生能力は極めて限られています。ただし、発生過程の間は、RPCは、たとえ発生が進んでも、前駆細胞らしさを保つ仕組みにより、枯渇を防ぎながら、継続的に新しい神経細胞を産生できます。
このRPC の前駆細胞らしさの維持には、遺伝子発現と、それを厳密に制御するためのクロマチンの開閉状態を含むエピゲノムが重要だと考えられてきました。しかし、どの因子が、クロマチン開閉状態を維持することで前駆細胞性を支えているのかは明らかになっていませんでした。
そこで本研究チームは、網膜前駆細胞の性質を維持するメカニズムの解明を目的に研究を行いました。具体的には、発生期のマウス網膜から前駆細胞を高純度で単離し、遺伝子発現とクロマチン構造を同時に測定するマルチオミクス解析を実施しました(図2)。
【本研究の内容】
本研究ではまず、発生期網膜から RPC を高純度で単離するため、RPC を特異的に標識できるマーカ ー遺伝子の探索から着手しました。その結果、脳の神経幹細胞マーカーとして知られる Nestin が、発生期網膜の網膜前駆細胞でも特異的に高発現していることを突き止めました。そこで、EGFP の蛍光を指標として Nestin 陽性細胞を回収できる Nestin-EGFP マウスを用いて RPC を単離し、遺伝子発現とクロマチンの開閉状態を同時に測定するマルチオミクス解析(RNA-seq+ATAC-seq、注 5、注 6) を行いました (図 2)。
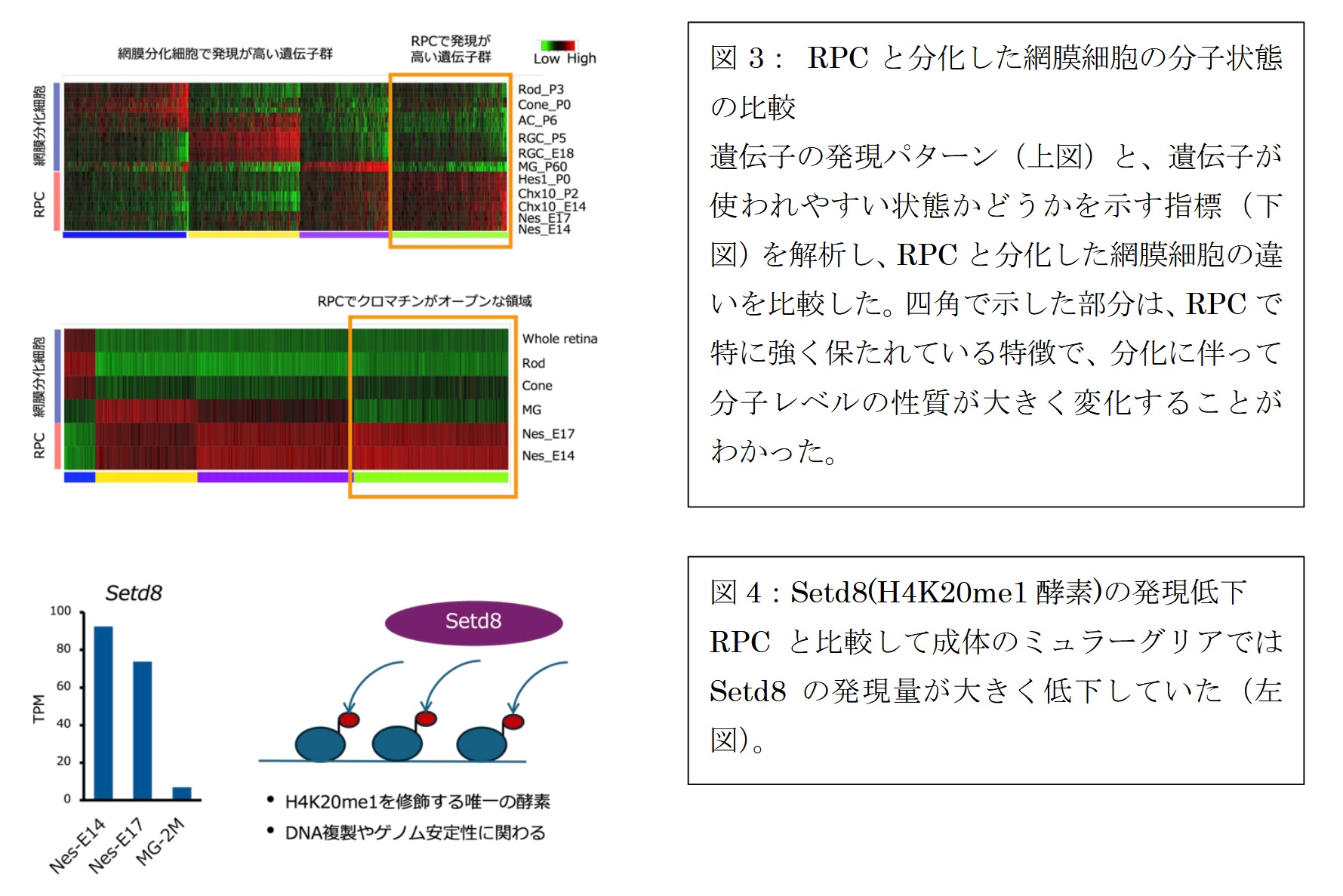
その結果、網膜細胞新生が進行する発生後期においても、RPC では前駆細胞特有のクロマチンの開閉状態と遺伝子発現パターンが維持されており、これが前駆細胞らしさを支える基盤になっていると考えられました (図3)。一方で、RPC から最終的に分化したミュラーグリア細胞では、前駆細胞性を定義する分子パターン(遺伝子発現・クロマチン状態)が大きく変化し、成熟後は神経新生能をほと んど示さないことも確認されました。
さらに統合解析から、RPC の性質維持を担う主要なエピジェネティック因子として Setd8 を同定しました。Setd8 は ヒストン H4 のリジン20番目に一重メチル化(H4K20me1、注7)を加える唯一 の酵素です (図 4)。Setd8 は、RPC では発生期を通じて持続的に発現する一方、成熟ミュラーグリア 細胞ではほぼ消失していました。
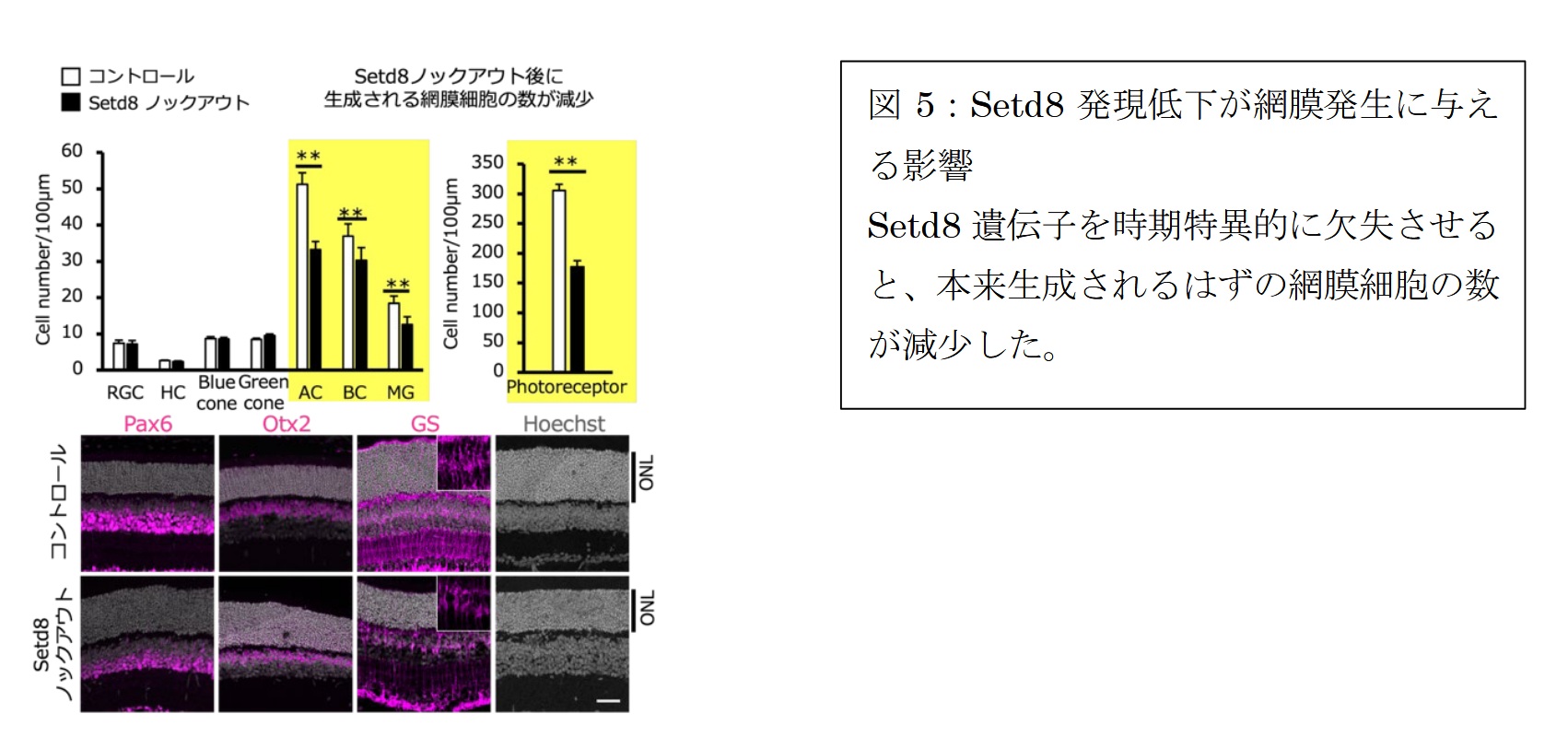
発生期の RPC において、 Setd8 を特異的に欠失させると、細胞増殖の低下、アポトーシスの増加、視細胞・神経細胞の産生数の減少、網膜層の菲薄(ひはく)化が生じました (図5)。また、Setd8 欠失により RPC 特有のクロマチン開閉状態が失われ、終末分化細胞に類似した遺伝子発現状態を部分的に獲得することも確認されました ( 図6)。
これらの結果から、Setd8 は RPC 特異的なクロマチンの開閉設計を維持することで、RPC の増殖能と神経新生能を支え、正常な網膜発生を保証する重要因子であることが明らかになりました。本研究は、網膜前駆細胞のアイデンティティを制御するエピジェネティック機構の理解を大きく前進させ、成熟後に再生能を失った網膜細胞へ、幹細胞性を再付与する網膜再生研究の基盤的知見となるものです。
【今後の展開】
本研究により、網膜前駆細胞に特有の遺伝子発現とクロマチンの開閉状態が発生後期に至るまで維持されていること、ならびにその維持に Setd8 が重要な役割を果たすことが明らかになりました。 今後は、Setd8 が制御するクロマチン領域や転写ネットワークをより詳細に解析することで、網膜前駆細胞の増殖能および神経新生能を支える分子基盤の理解がさらに深まると期待されます。
また、本研究で示された網膜前駆細胞とミュラーグリア細胞の間にある、クロマチンの開閉状態と遺伝子発現ネットワークの違いは、ミュラーグリア細胞から網膜前駆細胞様状態への運命転換(ダイ レクトリプログラミング)を目指す研究において重要な手がかりになります。将来的に、Setd8 など のエピジェネティック制御因子を活用してミュラーグリア細胞から RPC への運命転換(ダイレクトリプログラミング)が可能になれば、損傷した網膜内で視細胞や神経細胞など多様な神経細胞を再び補充する新しい網膜再生戦略につながる可能性があります。

【用語解説】
注 1 網膜前駆細胞 (RPC):
発生期の網膜に存在する未分化な細胞で、将来、視細胞や神経細胞、ミュラーグリア細胞など、すべての網膜細胞のもとになる細胞。分裂を繰り返しながら、決まった順序でさまざまな網膜細胞へと分化する。
注 2 Setd8:
ヒストン H4 の 20番目のリジンに一重メチル化(H4K20me1)を施す酵素。この修飾は細胞の増殖やゲノムの安定性に関与しており、網膜前駆細胞の性質維持に重要な役割を果たしている。
注 3 クロマチンの開閉状態:
DNAがどれだけ「読み取られやすい状態」にあるかを示す指標。クロマチンが開いた状態では遺伝子が働きやすく、閉じた状態では遺伝子の働きが抑えられる。
注 4 エピゲノム:
DNAそのものの配列を変えることなく、遺伝子の発現を制御する仕組みの総称。ヒストン修飾や DNAメチル化などが含まれ、細胞の状態や機能を決定づける。
注 5 RNA-seq(遺伝子発現解析):
細胞の中でどの遺伝子がどれくらい働いているか(RNAの量)を網羅的に読み取る技術。細胞の状態や機能の変化を高感度に測定できる。
注 6 ATAC-seq(クロマチン構造解析):
DNAが巻きついたヒストンの配置や構造から、遺伝子が読み取られやすい“開いた状態”か、働きが抑えられた“閉じた状態”か(クロマチンの開閉状態)を網羅的に測定する技術。エピゲノム制御の実態を捉えられる。
注 7 H4K20me1:
ヒストン H4 タンパク質のリジン 20番目に一重メチル化が加えられた修飾のこと。細胞周期制御やゲノムの安定性に関与している。
【掲載論文】
タイトル:Histone methyltransferase Setd8 preserves chromatin accessibility to safeguard retinal progenitor cell identity during development
著者:Haruka Sekiryu, Sakurako Shimokawa, Kanae Matsuda-Ito, Hisanobu Oda, Yusuke Murakami, Koh-Hei Sonoda, Kinichi Nakashima, Taito Matsuda
掲載誌:Stem Cell Reports
DOI:10.1016/j.stemcr.2025.102789
原著論文URL:https://www.cell.com/stem-cell-reports/fulltext/S2213-6711(25)00393-5
~責任著者からの一言~
私たちの研究室では、細胞の運命を自在に変化させる「細胞リプログラミング」技術に注目し、これまでにも体細胞から神経細胞への直接的なリプログラミング法の開発に取り組んできました。その経験から、再生能が低い成体網膜においても、網膜に存在する細胞から、再生能を有する前駆細胞へリプログラミングすることも実現可能、リプログラミングに必要な遺伝子を同定したいと考え、本研究に取り組みました。本研究で、「前駆細胞らしさを支える仕組み」の一端を解
明できたことを嬉しく思っています。共同研究者の先生方、学生・スタッフ、皆様の努力に心から感謝いたします。また、今後、網膜再生を可能にする技術を開発したいと考えています。再生は、非常に困難ではありますが、どれだけ研究に時間がかかっても、諦めずに取り組むことで必ず達成すべきことです。熱意ある学生の参加をお待ちしています。
奈良先端科学技術大学院大学
准教授 松田 泰斗
【脳神経機能再生学研究室】
研究室紹介ページ:https://bsw3.naist.jp/courses/courses314.html
研究室ホームページ:https://bsw3.naist.jp/matsuda/
(2026年02月02日掲載)
 奈良先端科学技術大学院大学
奈良先端科学技術大学院大学