器官サイズの左右差を抑制する仕組み -適切な血糖値の調節が器官サイズのばらつきを抑制する-
器官サイズの左右差を抑制する仕組み -適切な血糖値の調節が器官サイズのばらつきを抑制する-
【概要】
理化学研究所(理研)生命機能科学研究センター成長シグナル研究チーム(研究当時)の松下亮太研修生(奈良先端科学技術大学院大学バイオサイエンス研究科修士課程学生)、西村隆史チームリーダー(奈良先端科学技術大学院大学バイオサイエンス研究科教育連携研究室、客員准教授)の研究チームは、栄養環境の変化に応じて血糖値を適切に調節する仕組みが、器官サイズのばらつきを抑制することを明らかにしました。
本研究成果は、発育・成長過程で経験するさまざまな体内・体外の環境変化に応じて、生体の状態を一定に保ち、器官サイズを正確に制御する仕組みを明らかにするものであり、今後、器官サイズ制御だけでなく、健康評価のさらなる理解に貢献すると期待できます。
今回、研究チームは、モデル生物としてキイロショウジョウバエ[1]を用いて、食後高血糖・空腹時低血糖などの血糖恒常性の破綻を引き起こす遺伝的変異が、「発育恒常性」の低下(個体間・個体内の器官サイズのばらつき)を引き起こすことを明らかにしました。さらに、さまざまな栄養ストレスを与えたところ、野生型のハエでは器官サイズのばらつきが大きく変化しなかったものの、遺伝的変異を持つと、発育恒常性のさらなる低下を示しました。これらの結果から、血糖値を適切に調節する代謝恒常性と発育恒常性の直接的な因果関係が示されました。
本研究は、オンライン科学雑誌『Communications Biology』(4月7日付)に掲載されました。
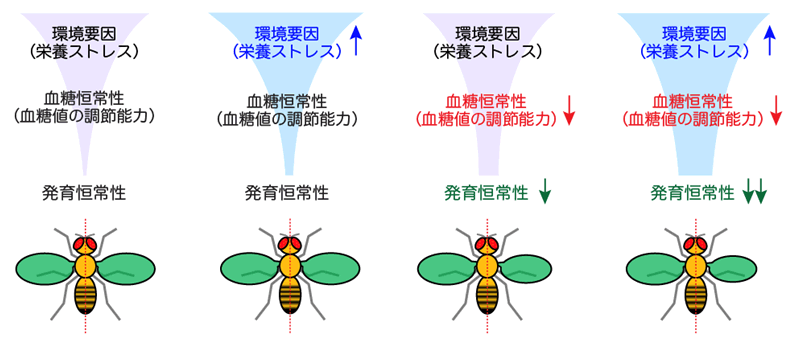
血糖恒常性の低下は、発育恒常性の低下(器官サイズのばらつき)を引き起こす
※研究支援
本研究は、日本学術振興会(JSPS)科学研究費補助金基盤研究B「栄養環境の変化に対する適応戦略と成長・代謝制御機構の解析(研究代表者:西村隆史)」、同挑戦的研究(萌芽)「最適制御理論に基づく環境依存的な成長と代謝の調節機構に関するeco-devo研究(研究代表者:西村隆史)」による支援を受けて行われました。
【背景】
多くの生物は、さまざまな環境変化にさらされても、安定した姿形と大きさを持つ個体に成長できます。この発育・成長過程における恒常性[2](「発育恒常性」)は、「発育ロバストネス[3]」と「発育安定性[4]」の二つの要因が関与しています。発育ロバストネスは、体外環境の変動に対する緩衝能力を意味しており、発育安定性は体内環境の局所的なゆらぎ(ノイズ)に対する緩衝能力を意味しています。
発育ロバストネスは、特定の環境条件下で育った生物集団における、器官サイズの個体間差で評価することができます(図1左)。つまり、同一の遺伝的背景[5]を持つ生物集団の個体間差が小さいほど、その遺伝的背景は発育ロバストネスが高いといえます。一方、発育安定性は、個体内の器官サイズの左右差で評価されています(図1右)。左右が相称な生物において、左右の器官を構成する細胞は、同じ遺伝的背景と体外環境を持つため、左右の器官サイズの差は、成長過程における細胞サイズと細胞数のゆらぎに起因していると考えられます。つまり、左右の器官サイズ差が大きいほど、ノイズに対する緩衝能力が低く、発育安定性が低いといえます。
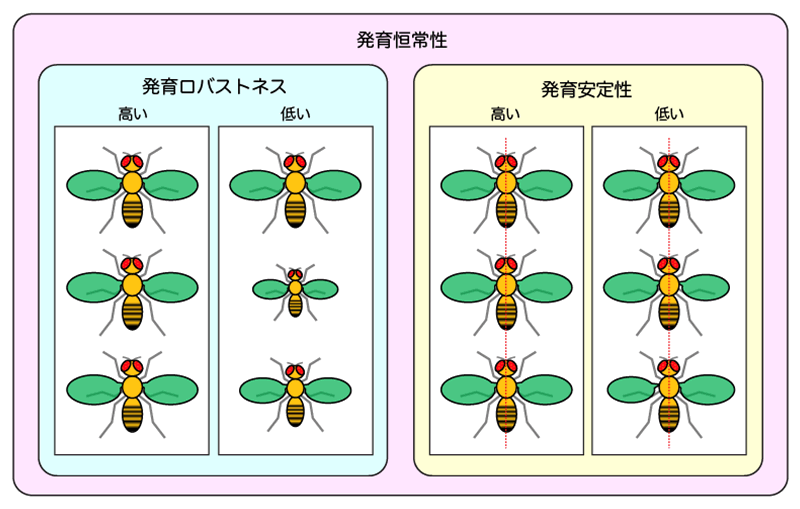
図1発育恒常性に関わる「発育ロバストネス」と「発育安定性」
発育ロバストネスが低いと、集団内での個体サイズや器官サイズのばらつきが生じる。一方、発育安定性が低いと、個体内での左右差のばらつきが大きくなる。
発育ロバストネスと発育安定性は、それぞれ単一の遺伝子で決まるものではなく、小さな影響を持つ複数の遺伝子が関わると理解されています。特に、発育安定性は、発育・成長過程における遺伝的または環境的なストレスを反映するため、ストレスや健康状態を評価する一つの手段として、ヒトを含めさまざまな動植物で調べられています。しかし、通常、左右差はわずかであるため、哺乳類における遺伝学的な研究は進んでいませんでした。一方、器官サイズを正確に測定し、定量的に評価できるキイロショウジョウバエの翅を実験モデルとして、発育恒常性に関わる遺伝子について、研究が進んできました。これまでに、細胞成長や細胞死に関わる遺伝子、転写因子[6]、マイクロRNA[7]などが、発育ロバストネスや発育安定性に関わることが報告されています。
一方、栄養環境の変化に対する「代謝恒常性」は、生体機能や器官成長を維持する上で重要な役割を果たしています。なかでも、生体内を循環する体液のグルコースは、細胞が必要とする重要なエネルギー源であるため、グルコース濃度を常に一定範囲に保つ必要があります。しかし、成長過程における代謝恒常性が、直接、「発育恒常性」に寄与しているのかどうか、これまで明らかになっていませんでした。
【研究手法と成果】
哺乳類の血糖はグルコースですが、ショウジョウバエをはじめとした昆虫の主な体液中の糖は、二糖のトレハロース[8]です。成長過程にあるハエの幼虫では、グルコースの100倍相当のトレハロースが体液中を循環しています。研究チームは以前、ショウジョウバエにおいて、トレハロース代謝が飢餓や低栄養状態における個体の生存と成長に重要な役割を果たすこと注1, 2)、さらに体液恒常性や乾燥耐性に関わること注3)を明らかにしていました。
トレハロースは、分解されるとグルコース2分子になるため、すぐに利用可能な体液中のグルコース貯蔵物質であると考えられています(図2左)。これを実験的に検証するため、トレハロース合成酵素(Tps1)の機能が低下する変異体(Tps1変異体)をさまざまな栄養条件で飼育し、体液中のトレハロース濃度及びグルコース濃度を質量分析装置[9]で調べました(図2右)。
その結果、通常餌で飼育した場合、Tps1変異体ではトレハロース濃度が低下する代わりに、グルコース濃度は野生型よりも高くなりました(食後高血糖の状態)。グルコースの上昇は、低糖質餌で飼育すると観察されないことから、餌由来の糖が原因であると考えられます。慢性的もしくは一過的に高糖質餌を与えると、野生型と比べてグルコース濃度がさらに高くなりました。逆に、通常餌で育てたハエを一過的に飢餓にさせると、野生型よりもグルコース濃度が低下してしまいました(空腹時低血糖の状態)。
これらの結果は、トレハロースはグルコースの貯蔵物質であるだけではなく、栄養環境の変動に対して、グルコース濃度を一定の範囲に保つ生理的な緩衝物質であることが分かりました。
![]()
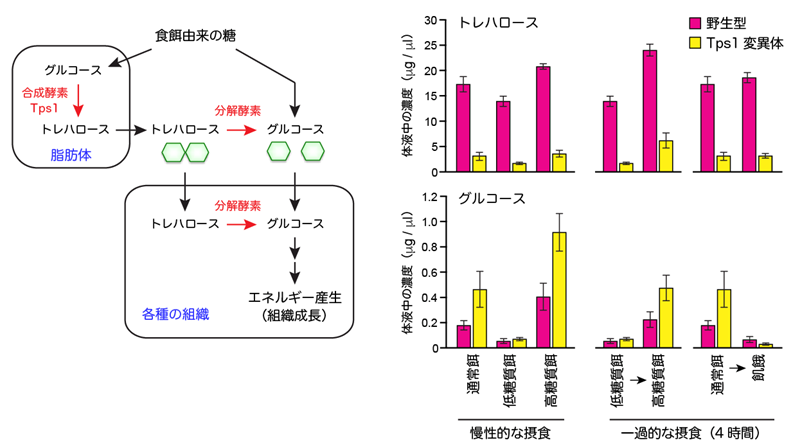
図2 トレハロース代謝経路と体液中の糖濃度の変動
(左) トレハロースは、食餌由来のグルコースをもとに、脂肪体と呼ばれる組織で合成酵素Tps1により生合成され、体液中に放出される。トレハロースは分解酵素の働きでグルコースに分解され、各種の組織や器官でエネルギー源として利用される。
(右) 各種の栄養条件で野生型とTps1変異体を飼育したときの、体液中のトレハロースとグルコースの濃度。一過的な摂食とは、餌を変えてから4時間の摂食を意味する。
Tps1変異体の多くは、成長過程で致死になるものの、一部の個体は一見して正常な姿形を持つ親ハエになります。そこで、直接グルコース恒常性の破綻を引き起こすことができる、Tps1変異体の親ハエの翅面積を測定することで、発育恒常性に与える影響を調べました(図3)。その結果、Tps1変異体の翅サイズは、野生型と比べて、集団内での個体間ばらつきと個体内での左右差がともに有意に上昇しました。よって、Tps1変異体は、発育ロバストネスと発育安定性の両方が低下していると考えられます。
成長過程において、ハエは生理的な低血糖状態を経験します。発育恒常性の低下の原因を調べる目的で、栄養条件を変えて実験を行いました(図3)。Tps1変異体を低糖質餌で育てると、通常餌と比べて、個体間ばらつきと個体内での左右差がともに著しく上昇しました。反対に、高糖質餌で育てると、個体間ばらつきは上昇するものの、個体内での左右差は、野生型と同程度にまで抑制されました。これらの結果から、極端な低血糖が発育恒常性の低下の原因になっていると考えられます。興味深いことに、通常餌による発育恒常性の低下は、雌雄ともに観察されるものの、低糖質餌による発育恒常性のさらなる低下は、雄のみで観察されました。よって、血糖代謝の破綻による発育恒常性の低下は、性によって異なることが示唆されました。
さらに、低タンパク質餌で育ったときの影響を調べました。雌雄ともに変異体では、通常餌と比べて、個体間のばらつきが著しく上昇するものの、左右差は通餌と比べて変化しませんでした。重要な点として、野生型のハエでは、このような低糖質餌や高糖質餌、さらには低タンパク質餌で育ったとしても、翅サイズの個体間差や左右差には、ほとんど影響が生じませんでした。よって、発育恒常性には、遺伝的な要因と環境要因が、相乗的に影響することが実証されました。
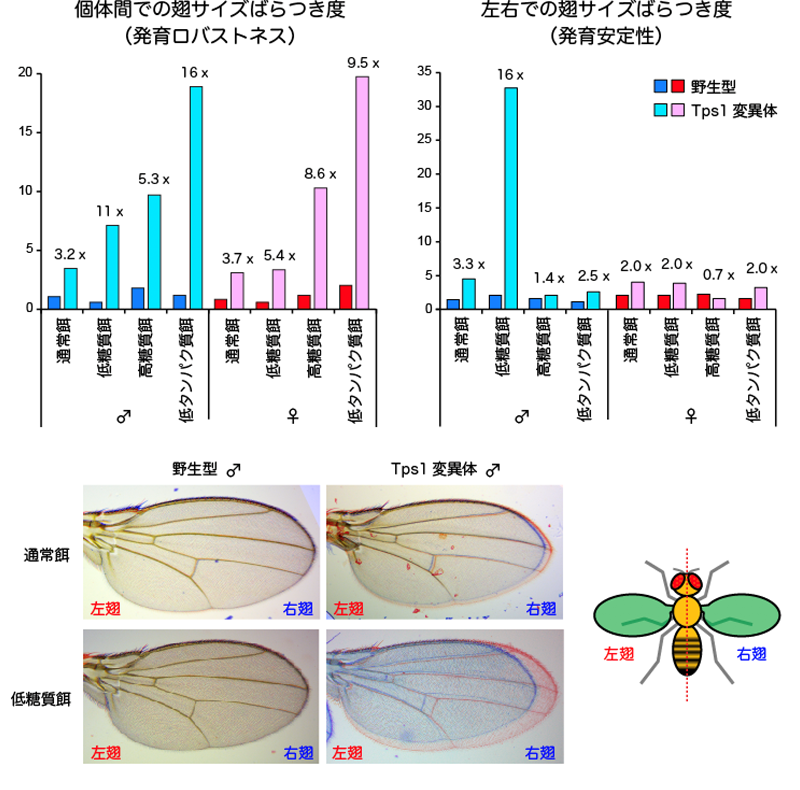
図3 野生型と変異体における発育ロバストネスと発育安定性
(上) 個体間での翅サイズのばらつき度と左右での翅サイズのばらつき度。ともに、縦軸の値が大きいほど、ばらつきが大きく、発育恒常性が低いことを意味している。数値は、各栄養条件において野生型と比較した値。
(下) 同一個体(雄)の右翅(青色)と左翅(赤色)を重ね合わせた写真。野生型では、左右の翅がほぼ完全に重なるが、Tps1変異体では左右のサイズが異なる。左右のサイズ差は、通常餌による飼育に比べて、低糖質餌飼育の方が大きい。
個体内での左右差が生じた原因を調べるため、翅の左右差が著しく異なる数個体について、翅を構成する細胞数と細胞サイズを調べました。その結果、左右の翅を比べると、細胞数と細胞サイズの両方に違いが生じていることが判明しました。このことから、適切な血糖調節による代謝恒常性は、器官を構成する細胞数と細胞サイズのばらつきを生み出すノイズを抑制することで、発育安定性に寄与していることが分かりました。
注1) 2014年12月22日CDBニュース「ハエが低血糖になると?
http://www.cdb.riken.jp/news/2014/researches/1222_5563.html
注2) 2017年5月17日CDBニュース「栄養不足環境を生き抜く鍵はトレハロースにあり」
http://www.cdb.riken.jp/news/2017/researches/0517_13407.html
注3) 2016年8月24日CDBニュース「トレハロースが体内の恒常性維持に重要なはたらき」
http://www.cdb.riken.jp/news/2016/researches/0824_11496.html
【今後の期待】
ヒトにおいて、器官サイズの対称性と認知症や生殖能力、知性といった生理機能との相関関係が指摘されています。また、ヒトとサルにおいて、妊娠糖尿病や高血糖といった病態生理は、子孫の発育安定性に影響することも報告されています。
発育恒常性は、身体の健康状態に関わる可能性があるため、今後、血糖恒常性と発育恒常性のさらなる理解は、さまざまな健康評価の遺伝学的な理解に貢献すると期待できます。
【論文情報】
<タイトル> Trehalose metabolism confers developmental robustness and stability in Drosophila by regulating glucose homeostasis
<著者名> Ryota Matsushita, Takashi Nishimura
<雑誌> Communications Biology
<DOI> 10.1038/s42003-020-0889-1
【補足説明】
[1] キイロショウジョウバエ
ハエ目ショウジョウバエ科の昆虫であり、さまざまな研究分野でモデル生物として用いられている。体長2~3 mm前後の小さな昆虫で、飼育が容易であり、遺伝学的な解析に優れた性質を持つ。
[2] 恒常性
生体の内部や外部の環境が変化しても、生体の状態を一定に保つ性質。一般に、何重もの調節メカニズムによって、恒常性が維持されている。生物が持つ重要な性質の一つである。
[3] 発育ロバストネス
環境や遺伝子型が変動したとしても、同じ形質を生み出す性質。1942年にWaddington博士が提唱したcanalizationと、ほぼ同義の言葉である。ロバストネスは、日本語では頑健性と訳される。
[4] 発育安定性
多細胞生物が持つ緩衝能力で、対称性のゆらぎ(Fluctuating asymmetry)としてさまざまな動植物で評価されている。形態形質的な対称性のゆらぎは、成長過程における、遺伝的または環境的ストレスを反映していると考えられている。
[5] 遺伝的背景
ある生物個体の姿形や大きさなどの表現形質を特徴づける、生まれ持った遺伝子全体の構造や機能。
[6] 転写因子
DNAの特定配列に結合し、遺伝子の発現を制御するタンパク質群。多数の転写因子が多細胞生物の発生や成長に関与している。
[7] マイクロRNA
DNA上にコードされ、最終的に20~25塩基長の小さなRNAとなる機能性核酸。タンパク質には翻訳されないものの、ほかの遺伝子の発現を調節する。
[8] トレハロース
グルコースが1,1-グリコシド結合してできた二糖。化学的に安定で、保湿作用やタンパク質の変性抑制作用を持つことから、さまざまな加工食品に利用されている。ヒトは自身で合成できないが、グルコースに分解して消化吸収することができる。
[9] 質量分析装置
試料に含まれる分子をイオン化し、その質量を測定する装置。微量な物質の定量が行える。
【原著論文】
https://www.nature.com/articles/s42003-020-0889-1
(2020年04月09日掲載)
 奈良先端科学技術大学院大学
奈良先端科学技術大学院大学