高木博史教授が長瀬科学技術振興財団から平成19年度研究助成を受賞しました
4月2日付けで、細胞機能学講座の高木博史教授が(財)長瀬科学技術振興財団から平成19年度研究助成を受賞しました。本助成金は、わが国の生化学及び有機化学等の分野における研究開発に対し助成等を行うことにより、科学技術の振興を図り、もって社会経済の発展に寄与することを目的として、同財団より授与されるものです。平成7年度には、同講座の桂樹徹准教授も助成を受けています。なお、授賞式は4月20日に執り行われました。
助成受託のコメント
 この研究助成にはこれまで何度も落ち続けていましたが、昨年本学に着任後ついに採択されたので、非常に感慨深いものがあります。Mpr1は12年前に始めた酵母の研究(ストレス耐性機構)を進める過程で、偶然に見出した新しい酵素です。最近では予想もしなかった生理機能(抗酸化能)も明らかになり、研究者人生の中で、最高のテーマかも知れません。まさに、研究の醍醐味である「Originality」と「Serendipity」が凝縮されており、これからも研究室の仲間と熱く研究に取り組みたいと思います。
この研究助成にはこれまで何度も落ち続けていましたが、昨年本学に着任後ついに採択されたので、非常に感慨深いものがあります。Mpr1は12年前に始めた酵母の研究(ストレス耐性機構)を進める過程で、偶然に見出した新しい酵素です。最近では予想もしなかった生理機能(抗酸化能)も明らかになり、研究者人生の中で、最高のテーマかも知れません。まさに、研究の醍醐味である「Originality」と「Serendipity」が凝縮されており、これからも研究室の仲間と熱く研究に取り組みたいと思います。
助成受託研究テーマ
「酵母の新規アセチル化酵素Mpr1による抗酸化機構の解明と高機能型Mpr1の創製」
酵母Saccharomyces cerevisiae Σ1278b株に発見した酵素Mpr1は、プロリンの毒性アナログをN-アセチル化し、解毒します。最近、Mpr1は熱ショック、冷凍-解凍、エタノール処理などにより細胞内に生じる活性酸素種(ROS)レベルを低下させ、酸化ストレスから細胞を防御していることが判明しました。ゲノム解析の結果から、Mpr1は酵母に広く存在していますが、既知の抗酸化酵素のようにROSに作用するのではなく、ROS生成に関与する化合物をアセチル化し、間接的にROSレベルを制御していると考えられます。今後、酸化ストレス下における細胞内基質の同定などを通して、Mpr1による新しい抗酸化機構を解明する予定です。また、X線結晶構造解析や変異型酵素の機能解析に基づき、抗酸化能の向上したMpr1を創製することにより、酸化ストレス耐性能を高めた実用酵母の育種への応用も期待できます。
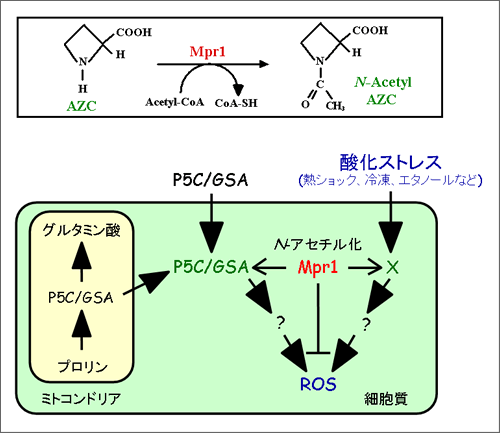
上:Mpr1によるプロリンアナログ(AZC)のN-アセチル化反応、下:Mpr1による抗酸化メカニズムのモデル(Mpr1はプロリン代謝中間体(P5C/GSA)をN-アセチル化し、ROSの生成を抑えている。一般的な酸化ストレスにおいても、未知の基質(X)をN-アセチル化し、ROSレベルを制御していると考えられる。
関連する論文
- 高木博史
酵母に発見した「アセチル化酵素Mpr1」による新しい抗酸化メカニズム 活性酸素種の生成に関わる物質を基質とした酸化ストレス防御システム?!
化学と生物, 44, 83-84 (2006). - X. Du, H. Takagi
N-Acetyltransferase Mpr1 conferred freeze tolerance in Saccharomyces cerevisiae by reducing reactive oxygen species. J. Biochem., 138, 391-397 (2005). - M. Nomura, H. Takagi
Role of the yeast novel acetyltransferase Mpr1 in oxidative stress: Regulation of oxygen reactive species caused by a toxic proline catabolism intermediate. Proc. Natl. Acad. Sci. U.S.A., 101, 12616-12621 (2004). - M. Nomura, S. Nakamori, H. Takagi
Characterization of novel acetyltransferases found in the budding and fission yeasts that detoxifies a proline analogue, azetidine-2-carboxylic acid. J. Biochem., 133, 67-74 (2003). - Y. Kimura, S. Nakamori, H. Takagi
Polymorphism of the MPR1 gene required for toxic proline analogue resistance in the Saccharomyces cerevisiae complex species. Yeast, 19, 1437-1445 (2002). - M. Shichiri, C. Hoshikawa, S. Nakamori, H. Takagi
A novel acetyltranferase found in Saccharomyces cerevisiae Σ1278b that detoxifies a proline analogue, azetidine-2-carboxylic acid. J. Biol. Chem., 276, 41998-42002 (2001). - H. Takagi, M. Shichiri, M. Takemura, M. Mohri, S. Nakamori
Saccharomyces cerevisiae Σ1278b has novel gene of the N-acetyltransferase gene superfamily required for L-proline analogue resistance. J. Bacteriol., 182, 4249-4256 (2000).
(2007年04月23日掲載)
 奈良先端科学技術大学院大学
奈良先端科学技術大学院大学