ストレス耐性を担う組織の発生機構解明
バイオサイエンス研究科分子発生生物学研究室の齋藤大介助教と高橋淑子兼任教授(現・京都大学理学研究科教授)らは、体の恒常性の維持やストレス耐性を担う重要な器官である交感神経と副腎の発生機構を解明しました。この成果は平成24年6月22日付けのScience誌に発表され、京都新聞、日刊工業新聞に記事として掲載されました。
齋藤大介助教のコメント
「副腎を構成する2つの細胞種である副腎髄質と副腎皮質は、はじめ体の別々に生まれるのに、どうやって出会えるのだろう?」という素朴な疑問が、この研究を行うきっかけでした。調べていくうちに副腎は、主役である副腎の細胞のはたらきだけでなく、いくつかの脇役や裏の主役的存在が多様かつ巧妙な役割を果たすことでできることがわかりました。研究はそのうち広がっていき、最終的には、副腎も含めた自律神経系の発生機構という、生物学的により意義のある仕事に仕上がったと思います。高橋教授との日々のディスカッションやラボメンバーのサポートがあって、論文としてまとめることができました。この場を借りてお礼申し上げます。
研究の概要
自律神経系は体内の恒常性の維持やストレス防御を行ううえで非常に重要な役割を果たしており、自律神経系の異常はさまざまな疾患を引き起こす。しかしながら、発生の間に自律神経系がどのように作られるのかについてはほとんど分かっていなかった。
自律神経系は、交感神経、副交感神経、および副腎から構成されている。なかでも交感神経と副腎髄質(以下、髄質)は、交感神経-副腎髄質前駆細胞(Sympatho-Adrenal progenitor cells: 以下、SA細胞)と呼ばれる共通の祖先細胞から生まれる。SA細胞ははじめに、神経管背側から背側大動脈(以下、大動脈)付近まで集団として移動する。次に、一部のSA細胞が大動脈に沿ってさらに腹側に移動してのちに髄質を形成する一方で、その場に留まり続けたSA細胞はのちに交感神経に分化する(図1)。交感神経と髄質の前駆細胞が示すこのような挙動から、大動脈がこれらの細胞の移動や系譜分岐に何らかの役割を果たすことが予想されていたものの、その内容についてはほとんど分かっていなかった。
そこで我々は、発生の間にどのようにしてSA細胞は大動脈まで移動するのか、また、どのようにして交感神経と髄質の系譜が分かれるのかについて調べた。SA細胞の移動に関しては、大動脈から分泌されるBMPが、周辺の間充織にSDF1 とNeuregulin 1の発現を誘導し、この2つの分子がもつ細胞誘引活性によってSA細胞がガイドされることを証明した。次の交感神経と髄質の系譜が分かれる機構に関しては、BMPシグナルが活性化された細胞が髄質に、不活性化された細胞がのちに交感神経になることを見つけた。髄質のその後の移動に関しては、大動脈周辺と副腎皮質で発現するNeuregulin 1がまたもや誘引因子としてはたらくこと、大動脈からのBMPがここでもNeuregulin 1の発現制御を行っていることが分かった。この研究の過程で、「副腎皮質が欠損していても正常にふるまう髄質がいるのはなぜなのか?」という長年の大きな疑問を解くこともできた。すなわち、「副腎皮質がなくなっても、大動脈周辺で発現しているNeuregulin 1が髄質を誘引するから」、というのが答えであった。総じて大動脈は、SA細胞の移動とその後の交感神経と髄質の細胞系譜分岐、および髄質の移動までをも制御するシグナルセンターとして機能すること、およびBMPシグナルがその中心であることが分かった(図2)。
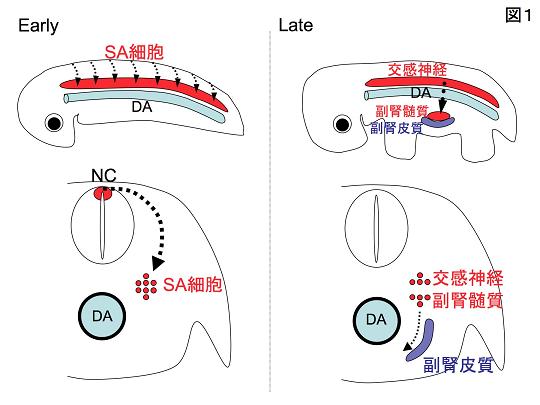 |
| 図1の説明 上が胚を横から見た全体像、下が胚の横断面の模式図である。SA細胞は神経堤(Neural Crest: NC)で生じ、背側大動脈(Dorsal Aorta: DA)まで移動する。発生後期になると、SA細胞の一部の集団はさらに腹側に移動し、副腎皮質(青色)と会合し、髄質に分化する。その場に留まり続けた細胞はのちに交感神経になる。 |
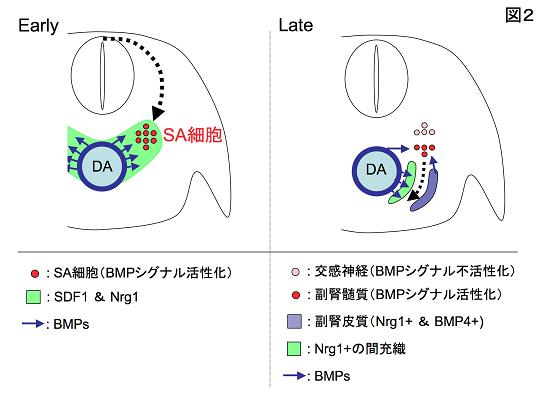 |
| 図2の説明 左:背側大動脈(DA)から分泌される因子(BMPを含む)によってDA周辺の間充織にSDF1とNrg1の発現が誘導される。SA細胞はSDF1とNrg1をアトラクタントして認識し、DAまで移動する。 右:DAと皮質からのBMPの影響によってSA細胞から髄質への分化が進行する。BMPは周辺間充織にもはたらきかけ、Nrg1の発現を誘導する(緑)。髄質は大動脈側のNrg1と皮質のNrg1に導かれて腹側に移動する。 |
関連論文
1. Yokota Y., Saito D., Tadokoro R. and Takahashi Y. Genomically integrated transgenes are stably and conditionally expressed in neural crest cell-specific lineages. Dev. Biol. 353. 382-395 (2011)
2. Yoshino T., Saito D., Tadokoro R. and Takahashi Y. In vivo gene manipulations of epithelial cell sheets: anovel model to study epithelial-to-mesenchymal transition. Dev. Growth Differ. 53. 378-388 (2011)
3. Watanabe T., Saito D., Tanabe K., Suetsugu R., Nakaya Y., Nakagawa S. and Takahashi Y. Tet-on inducible system combined with in ovo electroporation dissects multiple roles of genes in somitogenesis of chicken embryos. Dev. Biol. 305. 625-636 (2007)
(2012年07月03日掲載)
 奈良先端科学技術大学院大学
奈良先端科学技術大学院大学