2023.09.01
マダニの新規小分子RNA経路とウイルスの相互作用
RNA分子医科学研究室・助教・椎森 仁美
- 要旨
- 小分子RNAは遺伝子発現や抗ウイルス免疫において機能します。小分子RNA経路は生物によって多様性が見られますが、代表的なモデル生物以外での知見は多くありません。特に植物や酵母で小分子RNA産生に機能するRNA依存性RNAポリメラーゼ (RdRP) の機能は、線虫以外での動物では不明でした。私たちは、病原体媒介節足動物であるマダニがRdRPを保有していることから、マダニの小分子RNA経路に着目しました。 私たちの研究から、マダニが新規小分子RNA経路を持っていること、小分子RNA経路がウイルスとの相互作用において重要な役割を持つことが明らかになりました。本稿では、このマダニの新規小分子RNA経路について紹介します。
- 主要関連論文
- Canran Feng, Kyosuke Torimaru, Mandy Yu Theng Lim, Li-Ling Chak, Masami Shiimori, Kosuke Tsuji, Tetsuya Tanaka, Junko Iida, Katsutomo Okamura. (2023) A novel eukaryotic RdRP-dependent small RNA pathway represses antiviral immunity by controlling an ERK pathway component in the black-legged tick. PLOS ONE, Public library of science, 2023 Jun 21 18(3): e0281195
DOI :10.1371/journal.pone.0281195
1.小分子RNA機構
20-30塩基の小さなRNAが、遺伝子がタンパク質として発現するまでの緻密な発現制御にはたらくことが知られています。この小分子RNAによる遺伝子発現制御は、生物の発生や分化といった生命現象、また、癌をはじめとした様々な疾患にも関与することがわかっています。さらに、無脊椎動物においては、小分子RNA経路は主要な抗ウイルス免疫機構として機能します。
小分子RNAは、自身の遺伝子から転写された小分子RNA前駆体、または細胞外から侵入してきた外来二本鎖RNAがDicerというRNA切断酵素によって20-30塩基に切断されます。この小分子RNAがエフェクターであるArgonaute (Ago) タンパク質に取り込まれ、相補的な配列を持つRNAを認識し、その標的RNAの分解や翻訳抑制を引き起こすことで遺伝子発現を抑制します (図1)。このように、小分子RNA機構ではRNA切断酵素であるDicerとエフェクターであるAgoが機能することが広い生物種で保存されていますが、それ以外に機能するタンパク質は生物間で多様性が見られます。例えば、酵母や植物、動物でも線虫においてはRNA依存性RNAポリメラーゼ (RdRP) が小分子RNAの生合成や、免疫反応を増幅させる二次小分子RNAの合成に機能することが知られています (図1)。しかしながら、RdRPは脊椎動物や昆虫では失われており、線虫以外の動物での機能はこれまで明らかになっていませんでした。そのため、RdRPを持つ生物の小分子RNA経路を解析することで、RdRP依存性の新たな小分子RNA経路や生物の多様性を明らかにできると考え、私たちは研究を行っています。
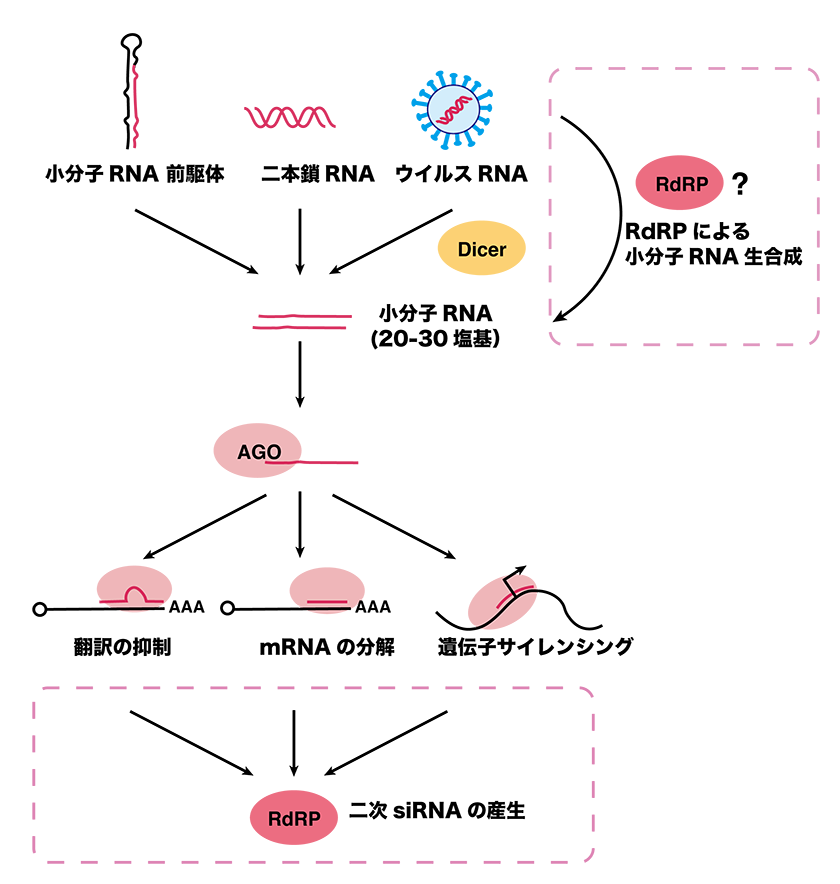
図1.小分子RNA経路とRdRPの機能
小分子RNA前駆体はDicerによってプロセシングを受け、この小分子RNAがAgoと複合体を形成し、遺伝子発現制御に機能する。RdRPは小分子RNA生合成や二次小分子RNAの合成に機能する。
2.マダニのRdRP依存性小分子RNA機構
節足動物のうち鋏角類に属する蜘蛛やマダニにおいてRdRPが保存されていることが近年報告されました (1)そこで、私たちは、病原体媒介節足動物であるマダニに着目しました。マダニは代表的なモデル生物と異なり、ゲノム情報の整備が十分には進んでいません。そこで、マダニにおいてどのような小分子RNAおよび小分子RNA関連因子が保存されているのか明らかにするため、シカダニIxodes scapularis胚由来培養細胞ISE6を用いて、トランスクリプトーム解析を行い、発現しているmRNAと小分子RNAを網羅的に解析しました。その結果、ISE6細胞において、小分子RNA経路で機能するDicerやAgoが発現していること、9つのRdRPタンパク質が保存されていることがわかりました。また、ISE6細胞では、他の生物でも見つかっているmicroRNAや反復配列由来の小分子RNA、mRNAに相補的な配列を持つ小分子RNAが発現していることを明らかにしました。これらに加え、これまで他の生物では報告されていない新しいタイプの小分子RNAが見つかったことから、マダニが新規小分子RNA経路を持っていることがわかりました。
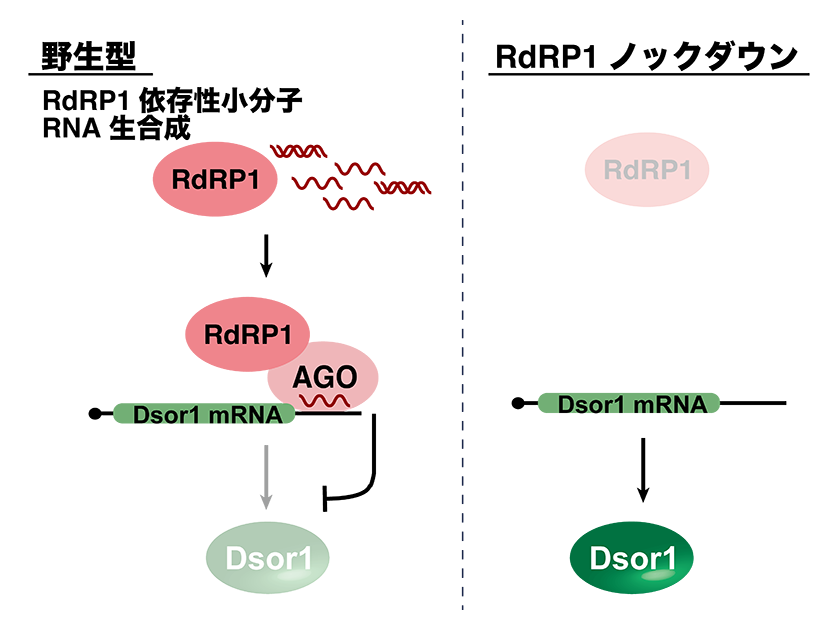
マダニにおいて、RdRPがどのような小分子RNA経路にはたらくのか明らかにするため、RdRPのうち発現量が高い遺伝子の一つであるRdRP1をノックダウンした細胞におけるトランスクリプトーム解析を行いました。その結果、RdRP1ノックダウン細胞では、RNAポリメラーゼIII転写産物由来の小分子RNAや、いくつかの反復配列由来の小分子RNA、mRNAに相補的な配列を持つ小分子RNAの発現が大きく減少していました。この結果は、これらの小分子RNAがRdRP依存的に産生されていることを示唆します。さらに興味深いことに、RdRP1ノックダウン細胞では、ショウジョウバエでウイルス免疫応答に機能するDsor1という遺伝子のmRNA発現が大きく上昇していました。そこで、Dsor1 mRNAに相補的な小分子RNAの発現を解析した結果、RdRP1ノックダウン細胞でその発現が顕著に低下していました (図2)。これらの結果は、RdRP依存的小分子RNAが内在性遺伝子の発現を制御することを示し、マダニにおけるRdRP依存性小分子RNAの標的内在遺伝子を初めて明らかにしました。これまで、小分子RNA経路はウイルス防御機構としてはたらくと他の生物での研究から考えられていましたが、マダニの小分子RNA経路が免疫応答遺伝子の発現抑制というウイルスにとって有利にはたらく予想外の機能を持つことがわかりました。
3.マダニ小分子RNA経路によるウイルス制御
マダニはウイルスや細菌、原虫といった様々な病原菌を媒介し、ヒトや動物に感染症をもたらします。ウイルス媒介生物であるマダニにおいては、ウイルスが感染しても病原性を発現することなく持続感染しており、マダニ由来培養細胞であるISE6細胞においても複数種のウイルスが持続感染していることが報告されています。マダニにおいては小分子RNA経路が主要な抗ウイルス機構として機能しています (図3a)。マダニ個体やマダニ培養細胞にウイルスが感染すると、宿主小分子RNA経路によりウイルスRNAからウイルス由来小分子RNA (virus-derived small interference RNA: vsiRNA) が産生されることやいくつかのAgoがウイルス制御に関与することが報告されています (2, 3)。
私たちは、AgoまたはRdRPノックダウン細胞におけるウイルスRNAやvsiRNA産生量を解析しました。ISE6細胞においても、持続感染ウイルス由来のvsiRNAの発現が確認できましたが、Ago, RdRPノックダウン細胞でもvsiRNAの発現量に大きな差は見られませんでした。次にウイルスRNA量を解析した結果、Agoノックダウン細胞では、いくつかの持続感染ウイルスのRNA発現量が増加していたことから、Agoが機能する小分子RNA経路は抗ウイルス免疫として機能すると考えられます (図3b)。一方、RdRP1ノックダウン細胞では、持続感染ウイルスのRNA発現量の有意な低下が見られました。この結果は、RdRP1がvsiRNAの産生によるウイルス増殖抑制とは異なる機能を介してウイルスRNA発現を制御している可能性を示唆します。
RdRP1は小分子RNAを介して免疫応答遺伝子Dsor1 mRNAの発現を抑制していることから、RdRP1ノックダウン細胞ではDsor1の発現が増加しウイルスRNA発現が抑制されていることが予想されました。この可能性を検証するため、RdRP1とDsor1の同時にノックダウンを行いました。Dsor1単独のノックダウンではウイルスRNA量は顕著に増加し、RdRP1とDsor1同時のノックダウンではDsor1単独のノックダウンと比べてウイルスRNA量の有意な低下は見られませんでした。これらの結果は、RdRP1ノックダウン細胞でのウイルスRNA発現低下は、Dsor1の発現上昇を介していることを示します (図3b)。マダニRdRP依存性小分子RNA経路はvsiRNA産生とは異なる機構でウイルス増殖を制御しているという興味深いウイルスとの相互作用を持つことが明らかになりました。
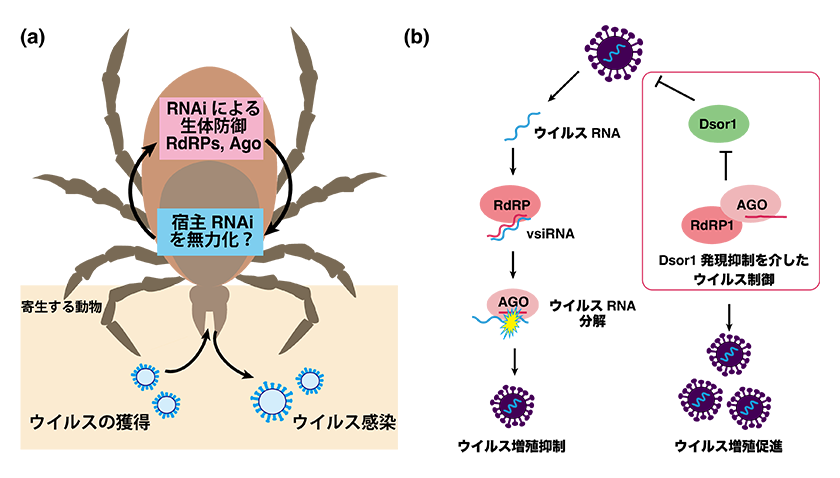
図3.マダニ小分子RNA経路とウイルスの相互作用
(a) マダニ小分子RNA経路は抗ウイルス免疫として機能する。(b) 宿主小分子RNA経路によるウイルス増殖抑制とDsor1発現制御を介したウイルス制御
5.研究の展望
これまでに、マダニがRdRP依存性の新規小分子RNA経路を持つことや、小分子RNA経路が内在遺伝子の発現制御を介してウイルス増殖に関与していることを明らかにしました。しかし、RdRP依存性小分子RNA経路の詳細な分子メカニズムや、ヒトに感染症をもたらすような外来性ウイルスが感染した際に宿主小分子RNA経路がどのような役割を担うのかについては依然として不明であり、現在研究を進めています。新たな小分子RNA経路のメカニズムを明らかにすることで生物の多様性を明らかにできるとともに、その応用により、現在のRNA干渉法を補完するような新たな手法の開発につながることも期待できます。
さらに、マダニは重症熱性血小板減少症候群 (SFTS) やマダニ媒介性脳炎 (TBE)、クリミア・コンゴ出血熱 (CCHF) といった重症化しやすく致死性が10-50%にも上る感染症の原因となるウイルスをヒトを含む動物に媒介します。SFTSやTBEは日本国内でも感染が報告されており、感染者数も増加傾向にあります。私たちは、これらのモデルウイルスやウイルス様粒子を用いて、マダニの小分子RNA経路がウイルス増殖をどのように制御しているのか解析を行なっています。また、培養細胞だけではなく、マダニ個体を用いた解析も進めており、マダニ個体の発生において重要な遺伝子や小分子RNAの同定を行なっています。さらに、培養細胞で明らかにした小分子RNA経路やウイルス制御機構が保存されているのか、マダニ個体で小分子RNA経路がどのような発生過程やウイルス免疫において機能を持っているのか明らかにするため研究をしています。マダニ媒介性ウイルス感染症であるSFTSやCCHFは、ワクチンや効果的な治療法が確立されておらず、ウイルス制御法や治療法の確立の基盤となる研究は必要不可欠です。マダニにおける宿主小分子RNA経路とウイルスの相互作用を理解することで、マダニにおけるウイルス制御へ貢献したいと考えています。
参考文献
椎森 仁美 NAIST Edge BIO, 0016. (2023)