2025.10.02
神経幹細胞老化のエピジェネティック制御因子Setd8の同定
脳神経機能再生学研究室・特任研究員・松田 花菜江
- 要旨
-
私たちの脳には、記憶や学習などの高次機能を司る海馬と呼ばれる領域があり、そこには新たな神経細胞(ニューロン)を生み出す「神経幹細胞」が存在します。神経幹細胞は、加齢とともに数が減少し、働きも衰えることが知られており、その結果として記憶力や学習能力の低下が引き起こされると考えられています。しかし、こうした変化がどのような分子メカニズムによって引き起こされるのかは、十分に解明されていませんでした。特に、加齢により神経幹細胞の遺伝子発現がどのように変化し、それがエピゲノム制御(DNAメチル化やヒストン修飾など)とどのように連動しているかについては、多くの謎が残されていました。
そこで、私達は、加齢に伴う神経幹細胞の機能変化の全貌解明と、将来的な「細胞の若返り」技術や加齢性疾患の新たな治療法の開発につなげることを目的として研究を開始しました。本稿では、その研究成果の概要について紹介します。
- 主要関連論文
- Matsubara S, Matsuda-Ito K, Sekiryu H, Doi H, Nakagawa T, Murao N, Oda H, Nakashima K, Matsuda T. Epigenetic Regulation of Neural Stem Cell Aging in the Mouse Hippocampus by Setd8 Downregulation. EMBO J. 2025 Jun 3. doi:10.1038/s44318-025-00455-8
1.はじめに
脳の海馬は記憶や学習などの高次機能を担い、その内部には新たな神経細胞を生み出す神経幹細胞が存在します(図1)。神経幹細胞は加齢に伴って数や機能が低下し(図2)、認知機能の衰えに関与すると考えられていますが、その分子メカニズムは十分に解明されていません。
特に、加齢による遺伝子発現変化とエピゲノム制御の関連については多くの謎が残されてきました。そこで本研究では、最新の単一細胞(シングルセル)解析技術を用いて神経幹細胞および分化系譜の遺伝子発現とエピゲノムを時系列的に解析し、加齢に伴う機能変化の全貌を明らかにすることを目的としました。その結果、神経幹細胞は若年期からすでに老化に類似した変化を示し、その一因としてエピジェネティック因子Setd8の発現低下が関与することを見出しました。
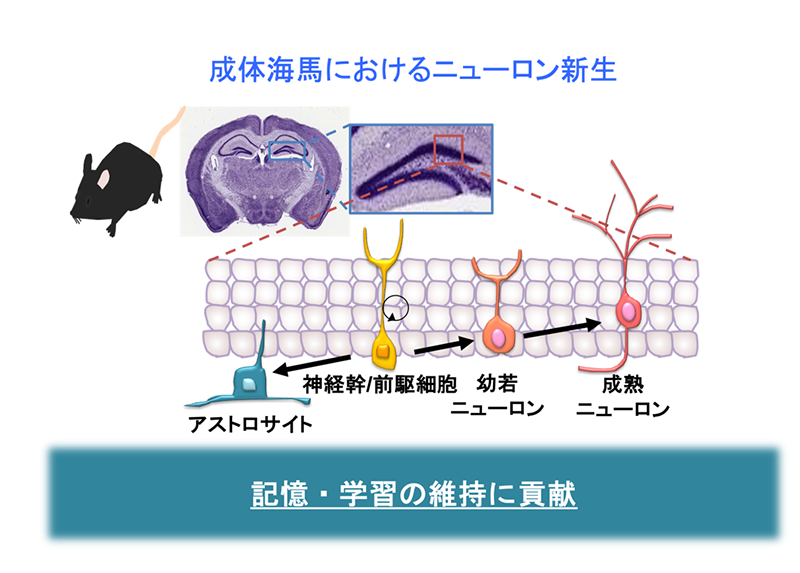
図1.海馬における神経細胞新生。ヒトを含めて大人の脳の海馬と呼ばれる領域では、神経幹細胞からニューロンが産生されています。
産生されたニューロンは海馬神経回路と接続することで、記憶・学習の維持に貢献しています。
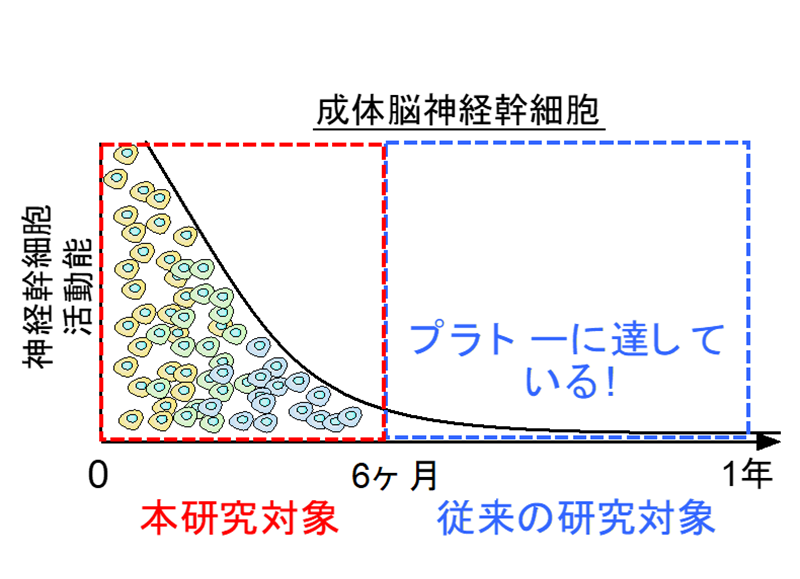
図2.加齢による神経幹細胞の機能低下。加齢に伴い、マウスの海馬神経幹細胞の増殖能、ニューロン産生能は急速に失われます。その結果、将来的な認知機能の低下につながるのではないかと考えられています。神経幹細胞機能低下は、アルツハイマー病による認知機能低下との関連も指摘されています。
2.シングルセル解析による神経幹細胞の加齢依存的変化の解明
本研究では、マウスの海馬に存在する神経幹細胞が加齢によりどのように変化するのかを明らかにするため、最先端のシングルセル解析技術を用いました。具体的には、神経幹細胞とその分化系列にあたる前駆細胞や新生ニューロンを対象に、シングルセル遺伝子発現解析(scRNA-seq)およびシングルセルクロマチン構造解析(scATAC-seq)を実施し、年齢によって生じるトランスクリプトームとエピゲノムの変化を時系列的に詳細に解析しました(図3)。その結果、神経幹細胞は、若齢期(生後5日)から成熟期(生後24週)にかけて、幹細胞の性質は保持しつつも、徐々に加齢に伴う特徴を獲得していくことが明らかとなりました。特に、細胞の増殖に関わる遺伝子の発現低下や、炎症応答、インターフェロンシグナルといった老化関連の遺伝子の活性化が確認されました。
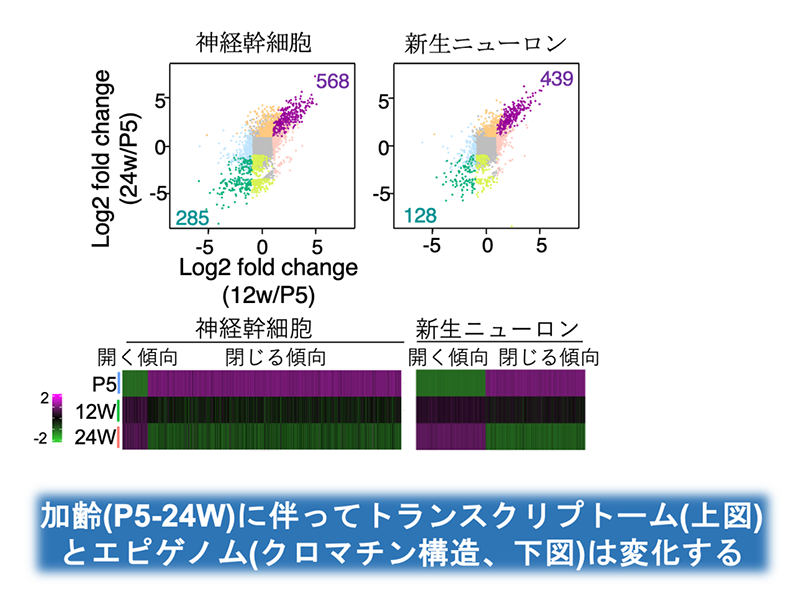
図3.シングルセル解析による加齢過程の遺伝子発現、エピゲノム変化。 シングルセル解析技術を駆使して、神経幹細胞およびその分化系譜の遺伝子発現(上図)とエピゲノムの変化(下図)を時系列的に解析した結果、成体マウスの海馬において、神経幹細胞が若年期からすでに老化に似た変化を始めていることを発見しました。
3.Setd8(H4K20me1酵素)の発現低下が老化を引き起こす
さらに解析を進めると、これらの加齢に伴う分子変化を引き起こす主要因として、DNA分子を巻き取るヒストンタンパク質を化学的に修飾して構造を変化させる酵素「Setd8」の発現低下が関与していることを突き止めました。Setd8は、ヒストン(H4)のアミノ酸配列で20番目のリジンに一重メチル化(H4K20me1)を施す唯一の酵素であり、その発現が低下すると、神経幹細胞におけるクロマチンの開閉状態が変化し、神経幹細胞の増殖能や神経分化能が著しく損なわれることが分かりました(図4)。
マウスで Setd8 を欠損させる実験では、神経幹細胞が急速に減少し、新しい神経細胞も生まれなくなり、記憶力の低下も見られました(図5)。また、Setd8の発現を一時的に抑制した場合には、神経幹細胞の機能低下が一過性であり、Setd8活性の回復によって再び正常な機能を取り戻すことができることも確認されました。これは、神経幹細胞の老化が少なくとも一部は可逆的であることを示しており、将来的な細胞の「若返り」誘導への道を開く重要な知見となります。
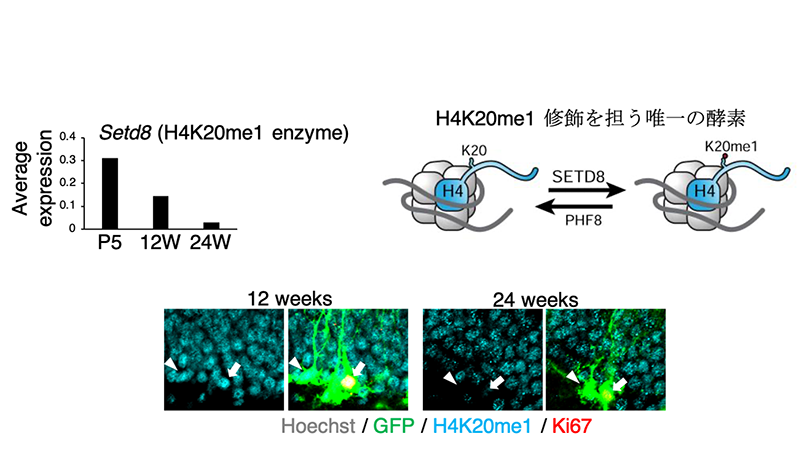
図4.Setd8(H4K20me1酵素)の発現低下。シングルセル解析データを用いて、加齢に伴い、マウスの海馬神経幹細胞においてSetd8の発現が減少し、その結果H4K20me1修飾レベルが低下することを見出しました。
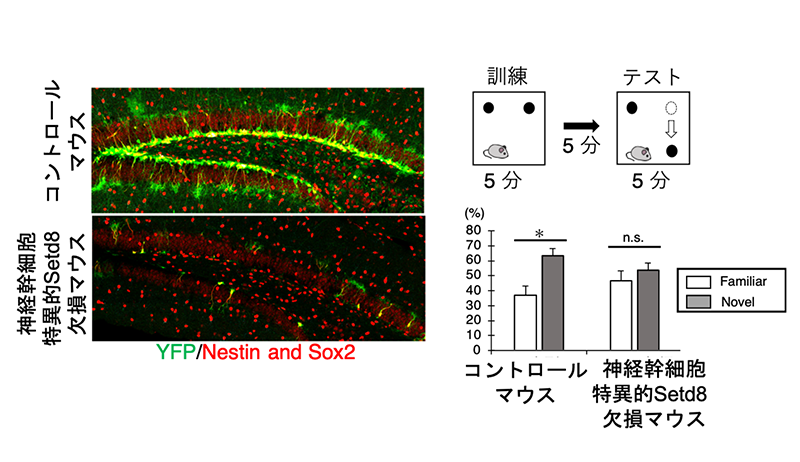
図5.Setd8の発現低下が与える影響。成体の神経幹細胞において特異的にSetd8を欠損させたマウスでは、YFP陽性の神経幹細胞が減少(左図)、その結果ニューロン新生が低下することで、記憶学習障害が認められました (右)。すなわち、若齢ステージにおいて、早期老化状態に陥ることを発見しました。
4.おわりに
本研究により、神経幹細胞の老化が特定のエピゲノム因子、Setd8の発現低下によって引き起こされ、かつその老化現象が可逆的である可能性が示されました。これは、加齢によって機能を失った細胞に再び若々しい性質を取り戻させる“若返りリプログラミング”の実現に向けた大きな一歩です。
今後は、老化に伴って機能が低下する他の幹細胞や神経系細胞においても、Setd8や関連するエピゲノム制御因子の役割を調べることで、老化に共通するメカニズムの解明が期待されます。また、Setd8の活性を制御する化合物や遺伝子導入技術を応用することで、加齢による脳機能の低下や神経変性疾患(アルツハイマー病など)への新たな治療法の開発につながる可能性があります。
さらに、今回得られた神経幹細胞の老化に関する網羅的な単一細胞データセットは、今後の再生医療・老化研究における重要なリソースとして広く活用されることが期待されます。
参考文献
- Zhao, C. et al. (2008) Cell 132, 645-660.
- Aimone, J.B. et al. (2014) Physiol Rev 94, 991-1026
- Moreno-Jiménez, E.P. et al. (2019) Nat Med 25 554-560.
- Navarro Negredo, P. et al. (2020) Cell Stem Cell 27, 202-223.
- Kennedy, B.K. et al. (1997) Cell 89 381-391.
- Sinclair, D.A. and Guarente, L. (1997) Cell 91 1033-1042.
- Yang, J.H. et al. (2023) Cell 186 305-326.e27.
- Nishioka, K. et al. (2002) Mol Cell 9 1201-1213.
- Tanaka, H. et al. (2017) Cell Rep 18 2148-2161.
- Gontier, G. et al. (2018) Cell Rep 22 1974-1981.
松田 花菜江 NAIST Edge BIO, 0032. (2025)

