2024.12.04
神経繊維の岐の生死を決定する翻訳制御機構
機能ゲノム医学研究室・助教・重岡 稔章
- 要旨
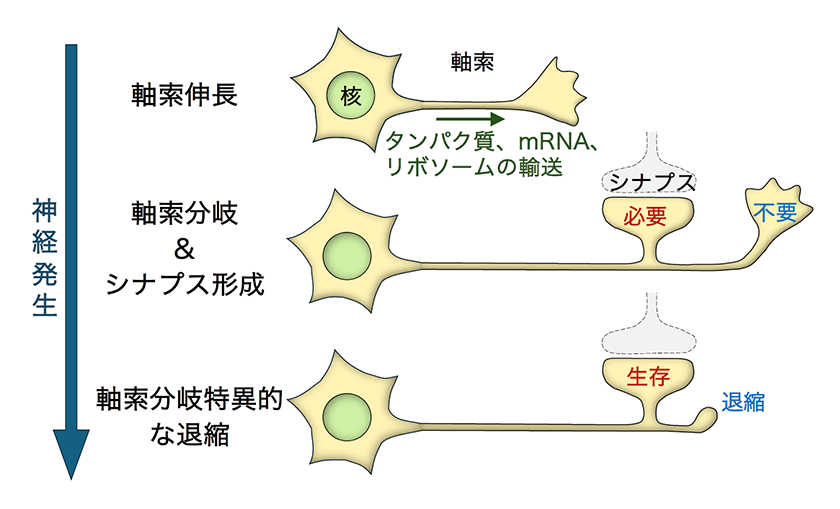
- 神経回路は、ニューロンから伸びる長い突起(軸索)が分岐し、他のニューロンとの間でシナプスと呼ばれる接続を形成することで構築されます。この過程では、正しい回路を構成する岐(軸索枝)やシナプスのみが選択的に残り、不必要な岐は退縮します。しかし、1本の軸索から分かれた複数の岐がどのように個別に制御されるかは、まだ明らかになっていません。また、軸索の退縮は、アルツハイマー病、パーキンソン病などの神経変性疾患や外傷による神経損傷にも関係していますが、発生過程での軸索退縮との関連性は不明です。特定の軸索枝に限局された退縮は、遺伝子の転写制御では説明がつかないため、私たちはmRNAの局在や翻訳制御といった転写「後」の仕組みに注目しています。本稿では、軸索枝ごとの退縮を制御する分子機構の解明に向けた研究について紹介します。
- 主要関連論文
- Shigeoka T, Jung H, Jung J, Turner-Bridger B, Ohk J, Lin JQ, Amieux PS, Holt CE. (2016) Dynamic Axonal Translation in Developing and Mature Visual Circuits. Cell, 166, 181-92,
doi: 10.1016/j.cell.2016.05.029. - Shigeoka T, Koppers M, Wong HH, Lin JQ, Cagnetta R, Dwivedy A, de Freitas Nascimento J, van Tartwijk FW, Ströhl F, Cioni JM, Schaeffer J, Carrington M, Kaminski CF, Jung H, Harris WA, Holt CE. (2019) On-Site Ribosome Remodeling by Locally Synthesized Ribosomal Proteins in Axons. Cell Reports, 29, 3605-19,
doi: 10.1016/j.celrep.2019.11.025.
1.神経発生後期におけるニューロン軸索での局所翻訳の未知の機能
神経回路は、ニューロンが軸索と呼ばれる長い突起を標的細胞に向けて伸ばすことで形成されます。軸索末端のタンパク質の多くは細胞核の近傍で作られて、それが軸索末端まで輸送されますが、一部は軸索末端まで運ばれたmRNAとリボソームによって局所的に合成されます(軸索内翻訳)。これまでの研究で、軸索内翻訳が軸索を伸ばす方向のコントロールに重要であることはわかっていますが1)、軸索の分岐やシナプス形成などの後期の発生過程での役割は明らかではありませんでした。しかし、新しく開発されたAxon-TRAPと呼ばれる手法を用いて2)、マウス中枢神経の軸索で翻訳されるmRNAを調べたところ、軸索の伸長過程よりもむしろ、その後の分岐やシナプス形成時期の方で、より多様なmRNAが高いレベルで翻訳されていることがわかりました3)。この結果から、発生後期や成熟したニューロンにおける軸索内翻訳の新しい役割が示唆されました。
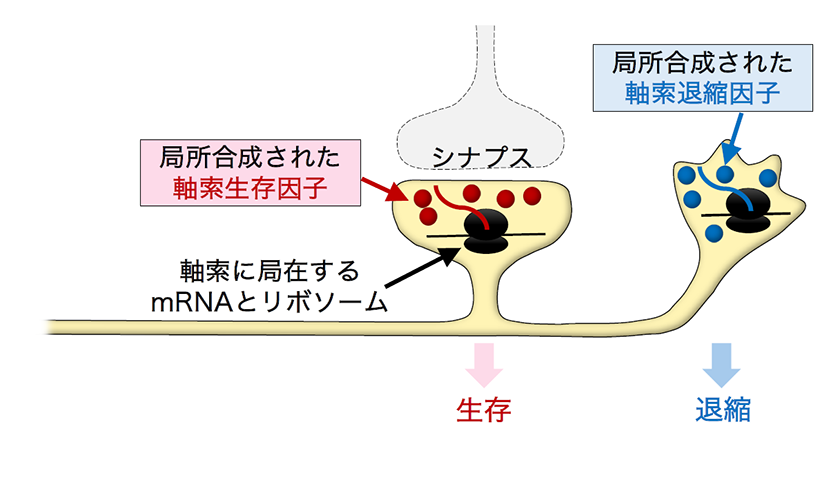
2.軸索の生存か退縮かを決定するタンパク質の局所合成
軸索の分岐やシナプス形成が起こる時期に軸索内翻訳されるmRNAを解析した結果、軸索の生存や退縮を制御する因子が多く含まれることがわかりました。さらに、Htt(ハンチントン病原因遺伝子)、Prnp(プリオン蛋白遺伝子)、App(アミロイド前駆体蛋白遺伝子)など、神経変性疾患に関連する遺伝子のmRNAも局所翻訳されていました3)。軸索の退縮は、神経変性疾患の発症や外傷性神経損傷の悪化に関わる重要な過程です。近年の研究により、これらの軸索退縮が受動的な現象ではなく、Nmnat2(軸索生存因子)とSarm1(軸索退縮因子)の拮抗的な相互作用を中心とする「プログラム軸索死」と呼ばれる遺伝子プログラムによって能動的に制御されていることが明らかになりました4)。しかし、このメカニズムの存在意義はまだ不明です。私たちの解析により、シナプス形成期や再編成期の軸索内で、Nmnat2などの軸索生存遺伝子とSarm1などの軸索退縮遺伝子の両方が局所翻訳されていることが確認されました。一方、成熟した神経回路を持つ成体マウスでは、軸索生存遺伝子のみが翻訳され、軸索退縮遺伝子の翻訳は検出されませんでした。これらの結果をもとに、私たちは「軸索岐特異的翻訳」仮説を提唱しています。この仮説では、神経回路形成時に、正しい回路を構成する軸索岐やシナプスでは「生存」遺伝子のmRNAが翻訳され、不要な軸索岐では「退縮」遺伝子のmRNAが翻訳されることで、不要な岐が選択的に刈り込まれます。一方、不要な岐やシナプスを持たない成熟した神経回路では、軸索の退縮を防ぐ「生存」遺伝子が主に翻訳されることになります。
3.mRNAとリボソームの両方に存在する翻訳制御機構
この仮説が正しいなら、一体どのようにしてmRNAの局所翻訳が制御されているのでしょうか?私たちは、遺伝情報を運ぶ媒体であるmRNAと、それをタンパク質に翻訳する装置であるリボソームの両方に着目して研究を進めています。コンピューター解析により、軸索内で特定の時期に翻訳されるmRNAの配列から、多くの新しい配列モチーフを発見しました。その中でも、CUIC (Cis-element Upstream of the Initiation Codon)という配列モチーフは翻訳開始コドンの直前に存在し、特徴的なRNA二次構造を形成することが分かりました5)。また、CUICはNetrin-1のような細胞外分子の刺激に反応して翻訳を促進する役割を持つことも確認しました。 一方、翻訳装置であるリボソームの側でも非常に興味深い事実が明らかになってきました。軸索の末端で、リボソームの構成因子であるリボソームタンパク質(RPs)が大量に合成されていることが判明したのです。リボソームは細胞核内の核小体で構築されるため、核から遠く離れた軸索末端でRPsが局所合成されているのは意外な発見でした。軸索内で翻訳されるタンパク質を質量分析により検出する新しい手法を用いることで、軸索内で合成されたRPsが軸索中に存在するリボソームに取り込まれることを明らかにしました。さらに、特定のRPの翻訳を軸索特異的に阻害すると、軸索分岐パターンに影響を及ぼすこともわかってきました5)。
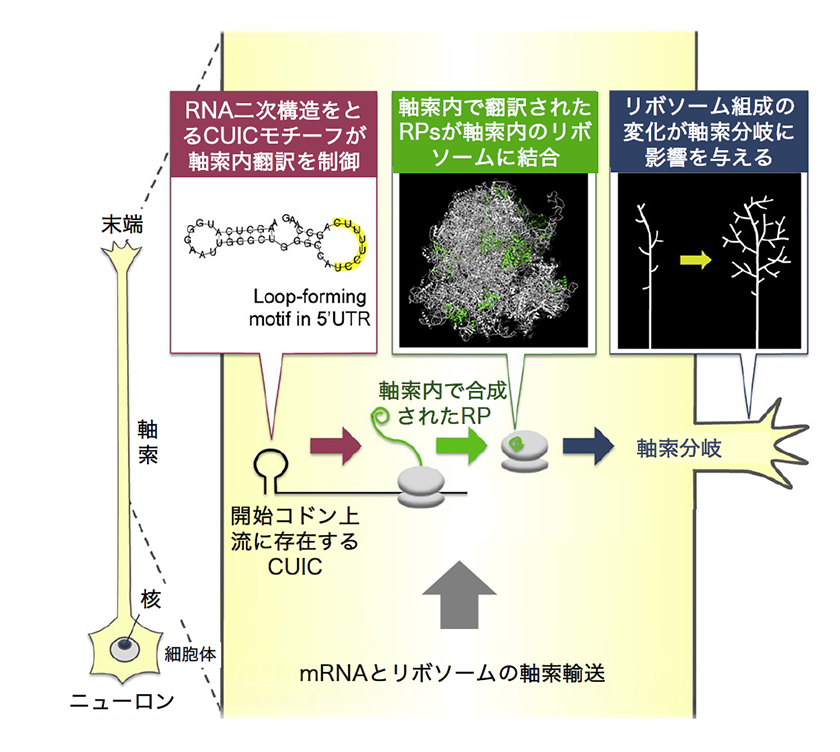
図3.軸索内の翻訳制御機構のモデル。mRNA上の開始コドンのすぐ上流に存在しRNA二次構造を形成するCUICモチーフが、軸索内翻訳を制御する。また軸索内で翻訳されたRPsは、リボソームに取り込まれ、リボソームの翻訳特性を変化させることで、軸索分岐を空間的に制御することができる。
4.おわりに
これまで、リボソームは決められたRPsのセットからなる均一の組成・構造を持ち、常に同一の構造を保ち続ける安定な複合体であり、 タンパク質合成を分け隔てなく行う装置であると考えられていました。しかし、私たちの発見により、リボソームの組成や翻訳性能が、状況に合わせて、ダイナミックに変化する可能性がでてきました。私たちは、翻訳される側であるmRNAだけでなく、翻訳する側のリボソームにも翻訳制御のための仕掛けが存在し、それらが連携して分岐特異的な軸索退縮を可能にしていると考え、研究を進めています。
参考文献
重岡 稔章 NAIST Edge BIO, 0028. (2024)