2023.05.01
植物ゲノムの可塑性を司る分子メカニズムと進化的意義
植物二次代謝研究室・助教・小牧 伸一郎
- 要旨
- 生命の設計図であるゲノムを正確に次世代に伝えることは、生物にとって最も重要な課題です。しかし、種子植物はその進化の過程で何度もゲノムを倍加させてきたことが知られています。また、ゲノム倍加した植物は生育が良くなるため、人為的にゲノムを倍加させた農作物が数多く作り出されてきました。このような可塑的なゲノム構成は植物を特徴付ける性質ですが、それを生みだす分子機構はわかっていませんでした。私たちは、植物細胞が継続的なストレスに晒されると、細胞周期チェックポイントの1つを制御することでゲノム倍加を引き起こすことを見出しました。本稿では、この植物特有の分子メカニズムを紹介するとともに、可塑的なゲノム構成が与える植物二次代謝産物の多様性への影響も考察したいと思います。
- 主要関連論文
- Komaki S and Schnittger A. (2017) The spindle assembly checkpoint in Arabidopsis is rapidly shut off during severe stress. Developmental Cell. Oct 23; 43 (2):172-185
DOI: https://doi.org/10.1016/j.devcel.2017.09.017 - Komaki S, Tromer E, Jaeger G, Winne N, Heese H, and Schnittger A. (2022) Molecular convergence by differential domain acquisition is a hallmark of chromosomal passenger complex evolution. PNAS. 119(42) e2200108119.
DOI: https://doi.org/10.1073/pnas.2200108119
1.はじめに
ゲノムとは、「生物をその生物たらしめるのに必要な最小限の染色体セット」として定義されています。ヒトをはじめとする多くの生物では、両親から1つずつ引き継いだ2つのゲノムセットを持つことから、「2倍体」と呼ばれる状態にあります。しかし、植物のなかにはゲノムセットを複数保持している種が多数存在し、「ゲノム倍加」が起こった状態にあります。多くの場合、ゲノム倍加を起こした植物は元の2倍体の植物と比べ、各細胞のサイズが大きくなるなど個体としても大きくなることが知られています。そのため、私たちが普段目にしている作物の多くにもゲノム倍加を起こしたものが用いられています。これは、古代から人類が行ってきた収量を基準とした育種は、無意識のうちにゲノム倍加した植物を選抜していたことに起因すると思われます。現在の育種においても、薬剤を用いることで人為的にゲノム倍加を引き起こした作物を作り出すことが盛んに行われています。また近年の研究から、現存する全ての植物はその進化の過程で少なくとも2度のゲノム倍加を起こしていることが明らかとなりました1)。つまり、ゲノム倍加が容易に起こる性質は植物が元来有している有用な特徴であり、農学的そして生物学的にも非常に興味深い現象ですが、その分子機構は分かっていませんでした。私たちは、植物細胞が継続的なストレスに晒されると、細胞周期チェックポイントの1つを制御することでゲノム倍加を引き起こすことを見出しました2)。本稿では、この植物特有の分子メカニズムを紹介するとともに、可塑的なゲノム構成が与える植物二次代謝産物の多様性への影響も考察したいと思います。
2.ゲノムの安定化に関わるM期チェックポイント
1つの細胞が分裂することによって2つの娘細胞を作り出すには、細胞周期と呼ばれる4つの特徴的な期間(G1期、S期、G2期、M期)を経る必要があります。この時、生命の設計図であるゲノムは染色体という形でS期に複製されます。その後に起きるM期では、染色体上に形成されるキネトコアと呼ばれる構造体に、細胞の両極から伸びてきた紡錘体微小管が結合し引っ張ることで各娘細胞への染色体の等分配が行われます。このM期における染色体の等分配こそが、生物がゲノムを安定して維持するために最も重要な課題です。そのため、真核生物の細胞には等分配が正確に行われているかを監視する、M期チェックポイントという機構が備わっています3)。M期チェックポイントは、Spindle assembly checkpoint (SAC)複合体とChromosomal passenger complex (CPC)複合体と呼ばれる2つの主要な複合体が協調して働くことで機能します(図1)。SAC複合体は、紡錘体微小管と結合していないキネトコアが存在するときに、細胞周期をM期中期に停止させます。いったん全てのキネトコアが紡錘体微小管と結合すると、SAC複合体の活性が抑制されることで、細胞周期がM期後期に移行します。これにより、染色体が少なくともどちらかの娘細胞に分配されることが保証されます。しかし、SAC複合体はキネトコアと紡錘体微小管の結合の有無のみを感知することから、同じ極から両方の姉妹染色体に結合するような異常な結合(シンテリック結合)が起こった場合にはうまく機能しません。そこで細胞は、姉妹染色体のキネトコアに均等な張力がかかっているかを認識するCPC複合体を備えています4)。CPC複合体は、シンテリック結合のような不均一な張力を発生させる紡錘体微小管を脱重合させることでキネトコアとの結合を解消し、異常な染色体分配を防ぎます。また、CPC複合体によって紡錘体微小管との結合を失ったキネトコアは、SAC複合体を活性化させます。このように、SAC複合体とCPC複合体が協調して働くことで、紡錘体微小管とキネトコアの正常な結合が完了するまで細胞周期をM期に停止させ、ゲノムの安定化が図られています。
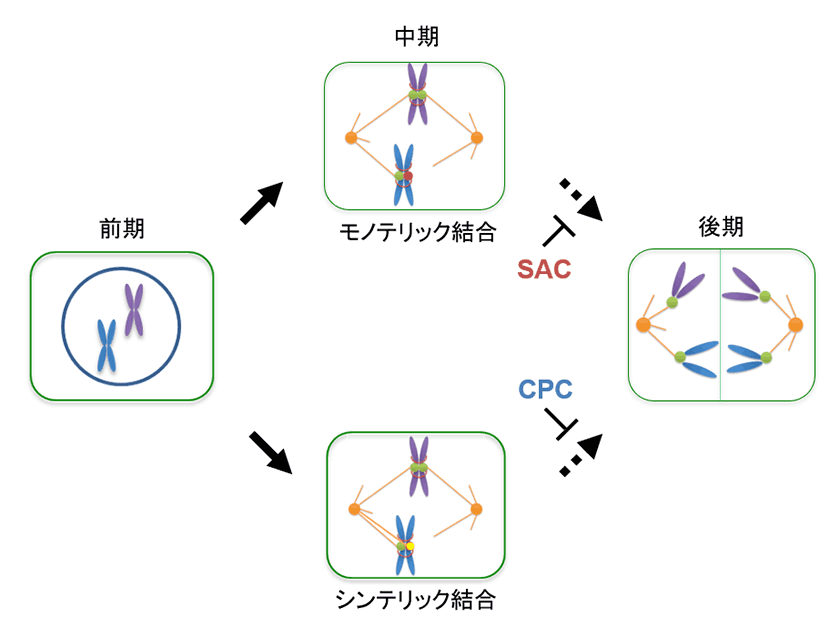
図1. M期チェックポイントによる細胞周期制御
モノテリック結合のような紡錘体微小管と結合していないキネトコア(赤)が存在するときは、SAC複合体によって後期への移行が抑制される。一方、シンテリック結合のような異常な結合を持つキネトコア(黄)がある場合には、CPC複合体によって後期への移行が抑制される。
3.ゲノム倍加を引き起こすM期チェックポイント制御機構
動物細胞に紡錘体微小管を破壊する薬剤を高濃度処理すると、M期チェックポイントが活性化することで細胞周期が停止し、その後死んでしまいます。一方、植物に薬剤処理を行うと容易にゲノム倍加した個体が得られることが古くから知られていました。これは、植物細胞にはM期チェックポイントが存在しないということを意味するのでしょうか?私たちがモデル植物であるシロイヌナズナを用いて調査したところ、低濃度の薬剤を処理した場合には、植物細胞でもしっかりとM期チェックポイントが機能していることが確かめられました2)。しかし、高濃度の薬剤を処理した際のM期チェックポイントの挙動が、動植物の細胞で異なることが明らかとなりました(図2)。動物細胞の場合、高濃度の薬剤に晒されると、M期での停滞が長時間(ヒトの細胞では約20時間)続いたのちに、M期チェックポイントが解除されることなくアポトーシスによる細胞の排除が起こります。これに対し、植物細胞を高濃度の薬剤で処理すると、M期での停滞は約2時間で終わり、薬剤による紡錘体微小管の破壊が続いているにもかかわらずM期チェックポイントが解除されることがわかりました。また、チェックポイントが解除された植物細胞は分裂を再開するのではなく、1つの細胞に戻ってしまうことも明らかとなりました。この元に戻った1つの細胞には、S期で複製された染色体がすべて取り込まれているために、ゲノム倍加を引き起こした細胞となっていました。つまり、植物がゲノム倍加を引き起こしやすい原因の1つには、この紡錘体微小管破壊時に起こるM期チェックポイントの解除機構が関与していることが示唆されました2)。
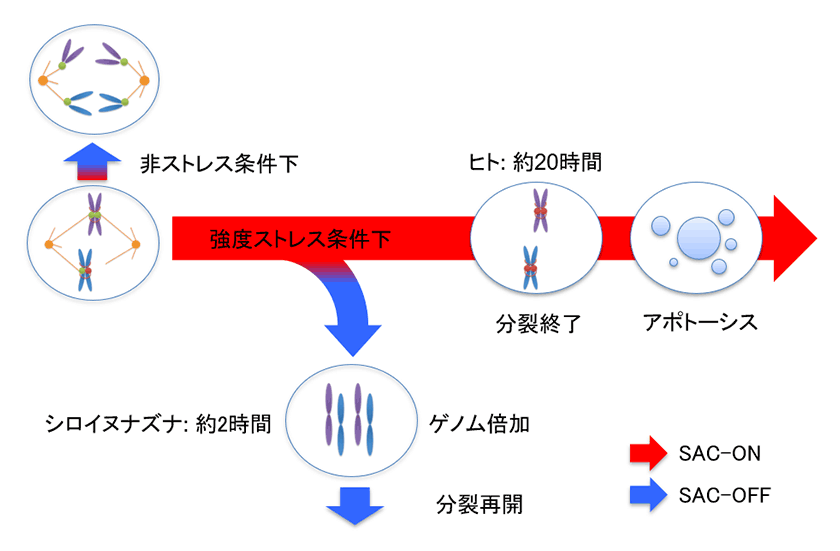
図2.植物細胞におけるストレス条件下でのゲノム倍加機構
動物細胞では、強度のストレスによってキネトコアと紡錘体微小管の結合が完了しない場合、SAC複合体が活性化したままアポトーシスが誘導される。一方、植物細胞では、キネトコアと紡錘体微小管の結合が完了しなくても、短時間でSAC複合体の活性が抑制され、1つの細胞に戻る。この細胞は、S期で複製した染色体をすべて持っているため、ゲノム倍加した状態にある。この細胞が分裂を再開することで、次世代においてゲノム倍加個体が誕生すると考えられる。
4.CPC複合体の局在機構の解明
酵母や動物の研究より、M期チェックポイントに関わるもう1つの主要複合体であるCPC複合体は、INCENP、ボレアリン(Borealin)、サバイビン(Survivin)の3つの足場タンパク質と触媒ユニットであるオーロラキナーゼ(Aurora kinase)によって構成されることが示されています(図3)。CPC複合体は、姉妹染色体が持つキネトコアの間の領域(インナーセントロメア)に特異的に局在することで機能します。染色体はHistoneと呼ばれるタンパク質群によって形作られていますが、このインナーセントロメアにあるHistone H3は、構成するアミノ酸の3番目のスレオニンがリン酸化という修飾(H3T3ph)を受けていることが知られています。CPC複合体の一員であるサバイビンはN末端にBIRというドメインを保持しており、このドメインが直接H3T3phに結合することでCPC複合体全体をインナーセントロメアに局在させる機能を持ちます4)。私たちは以前、モデル植物であるシロイヌナズナを用いて、植物にもINCENP、ボレアリン、そしてオーロラキナーゼが存在し、CPC複合体としてゲノムの安定化に関わることを見出しました5)。しかし、CPC複合体の局在に重要な役割を果たすサバイビンのホモログは、植物はおろかこれまでに存在が確認されていた酵母や動物以外の多くの生物では見つからないことがわかりました。そこで、植物でのCPC複合体の局在機構を明らかにすることとしました。酵母や動物のサバイビンはC末端にあるヘリックス構造でINCENPとボレアリンに結合することが知られていました。この情報をもとに、植物のボレアリンに結合する因子の同定を試みました。すると、Borealin-related interactor 1および2(BORI1およびBORI2)と名付けたタンパク質が、C末端のヘリックス構造でボレアリンと直接結合することがわかりました。このBORI1とBORI2のN末端には、FHAというサバイビンのBIRドメインとは全く異なるドメインが保存されていました。また、C末端のヘリックス構造を構成するアミノ酸の1次配列もサバイビンのものとは大きく異なっていたことから、タンパク質機能が不明でした。そこで、構造予測プログラムを用いてBORI1とBORI2のC末端領域の立体構造を予測しました。すると、アミノ酸配列自体の保存性は極めて低いにもかかわらず、最もよく似た立体構造はサバイビンの持つヘリックスと同様であると推定されました。さらに解析を進めたところ、BORI1とBORI2のN末端にあるFHAドメインがH3T3phに直接結合することで、植物のCPC複合体をインナーセントロメアに局在させる働きを持っていることが示されました。つまり、BORI1とBORI2は酵母や動物のサバイビンと同様の機能を持つことが明らかとなりました6)。
それでは、これら2つのタイプのタンパク質はそれぞれの生物で独立に誕生したのでしょうか?この疑問に答えるために、隠れマルコフモデルを用いた相同性検索を行ったところ、BORI1/BORI2とサバイビンの持つヘリックス領域は、もともと同一のタンパク質に由来すること、また初期の真核生物はこのヘリックスのみから構成されたタンパク質を保持していたことがわかりました。そして、その後の進化の過程で、各生物群において異なるH3T3ph結合ドメインが付加されるという収斂進化が起こったことが明らかとなりました。これにより、これまでBIRドメインを持つことが特徴であると考えられていたサバイビンの本体が、ヘリックス領域であると再定義することが可能となり、酵母や動物、そして植物以外の生物にもサバイビン/BORIに属するタンパク質が普遍的に保存されていることを発見することができました6)。
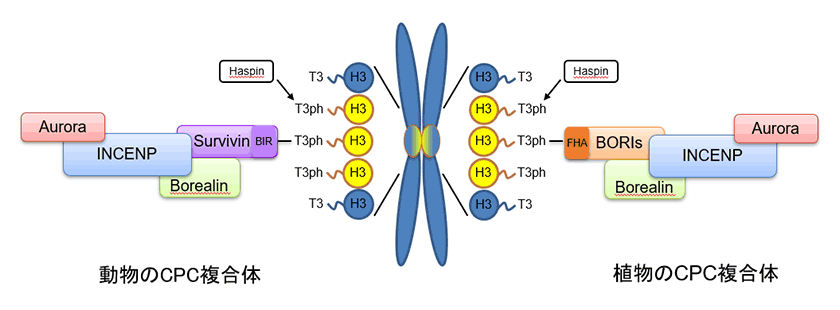
図3.動植物のCPC複合体構成因子
動物と植物のCPC複合体は、それぞれSurvivinのH3T3ph認識ドメイン(BIR)と、BORIsの持つH3T3ph認識ドメイン(FHA)によってキネトコアに局在する。本研究によって、SurvivinとBORIsタンパク質は共通祖先を持つことが明らかとなり、収斂進化によって異なるH3T3ph認識ドメインを獲得したことが示された。
5.遺伝子重複と植物二次代謝産物の関係
生存に必須であり、ほぼ全ての生物が作り出す物質である一次代謝産物に対し、ある生物が特定の環境下や組織でのみ作り出す物質を二次(特化)代謝産物と呼びます。動くことのできない植物は、様々な二次代謝産物を産生することで周囲の環境変化に適応進化することが知られています。その数は100万種類にものぼると考えられており、病害虫への防御や微生物との共生、花粉を媒介する昆虫の誘因、そして強光や乾燥といった環境ストレスへの応答など様々な役割を担っています。また、植物の作り出す二次代謝産物には、ヒトに対して機能性を示す成分が多数存在し、香りや色、味に関わるものやカロテノイドやフラボノイドのような健康増進や疾病予防に良いとされるのも多く、その有用性に大きな注目が集まっています。この多様性を生み出す原動力の一旦となっていると考えられるのがゲノム倍加を含む遺伝子重複現象です。ゲノム倍加が起こった個体では、同じ遺伝子が重複して存在していることから、1つの遺伝子が元の機能を維持しつつ、もう片方の遺伝子が変異を重ねることで新機能を獲得することが可能です。実際、私たちの研究室が行ったフラボノイド類の蓄積と生育環境の相関関係を調べた研究では、紫外線照射量が高い地域に自生するシロイヌナズナのみが、機能的なFPT2という遺伝子を保持していることがわかりました(図4)7)。また、見出したFPT遺伝子群は、遺伝子重複により機能分化が進んでおり、中でもFPT2はフラボノイド配糖体にポリフェノール性修飾鎖を付加することで、紫外線吸収能が高いフラボノイド(フェニルアシル化フラボノイド)を作り出すことが分かりました。この結果は、遺伝子重複が生み出す植物二次代謝産物の多様性が、環境適応進化に重要であることを示す一例であるといえます。
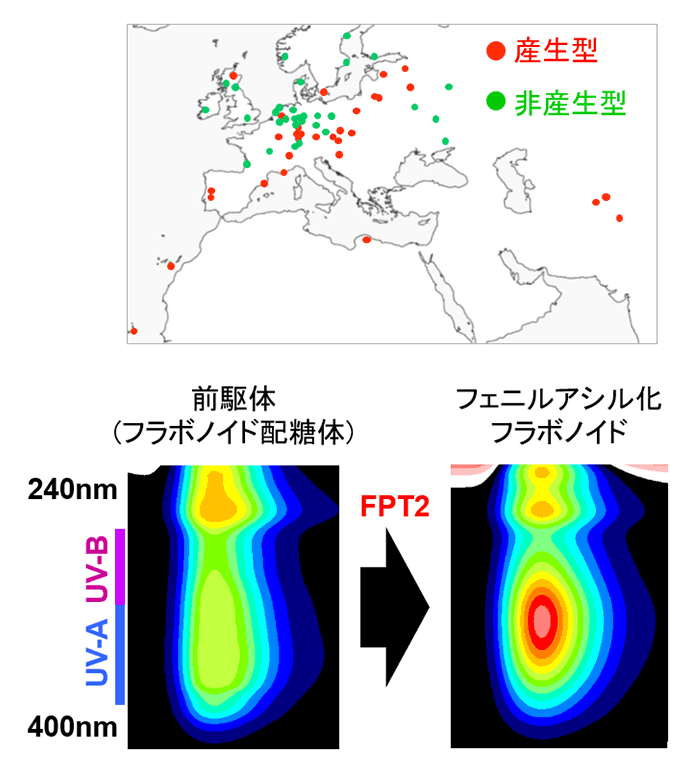
図4.FPT2による紫外線高吸収フラボノイドへの変換
紫外線照射量が高い地域に自生するシロイヌナズナは、フェニルアシル化フラボノイドを蓄積していることが明らかとなった。この紫外線吸収能が高いフラボノイドは、遺伝子重複によって新たに生みだされたFPT2遺伝子によって作り出されることが分かった。
6.おわりに
近年の研究より、ゲノム倍加が植物の種進化の原動力となっていることが明らかになりつつあります8)。私たちの研究は、このゲノム倍加自体が起こることを可能としている分子メカニズムとして、植物に特異的なM期チェックポイントの制御機構が存在することを見出しました。これは、可塑的なゲノム構成を持つ植物の特性をうまく説明できる機構であり、植物という生物の生き方を理解するうえで重要な発見になったと考えています。一方で、ストレス条件下においてチェックポイントを解除する仕組みなど、不明な点はまだまだ残っています。チェックポイントの監視対象であるキネトコアの研究も同時に進めることで、新たな発見が出来ることを期待しています。また、二次代謝産物に関わる遺伝子のように、ゲノム倍加が起こったあとに生み出される多様性の理解には、情報科学を用いた解析が極めて有効であり、植物が重ねてきた進化の軌跡をたどるような研究に取り組んでいきたいと思っています。
参考文献
- Van de Peer Y, et al. (2017) Nat Rev Genet. 18, 411-424
- Komaki S and Schnittger A. (2017) Dev Cell. 43, 172-185
- London N and Biggins S. (2014) Nat Rev Mol Cell Biol. 15, 736-748
- Carmena M, et al. (2012) Nat Rev Mol Cell Biol. 13, 789-803
- Komaki S, et al. (2020) Plant Physiol. 183, 1586-1599
- Komaki S, et al. (2022) Proc Natl Acad Sci U S A. 119, e2200108119
- Tohge T. et al. (2016) Nat Commun. 7, 12399
- Paape T. et al. (2018) Nat Commun. 9, 3909
小牧 伸一郎 NAIST Edge BIO, 0012. (2023)

