研究成果の紹介
タンパク質を生み出す酵母の新たな品質管理システムを発見
分子の立体構造の異常を生産器官内外で連携してチェック 高品質の有用なタンパク質の生産効率向上へ
タンパク質を生み出す酵母の新たな品質管理システムを発見
分子の立体構造の異常を生産器官内外で連携してチェック 高品質の有用なタンパク質の生産効率向上へ
【概要】
奈良先端科学技術大学院大学(学長:塩﨑一裕)先端科学技術研究科バイオサイエンス領域の木俣行雄准教授の研究グループは、アルコールの一種のメタノールを材料に医療用タンパク質などを作り出すためによく使われるメタノール資化性酵母「Pichia pastoris (P. pastoris: ピケア パストリス)について、この酵母が細胞内の小胞体という器官で生み出したタンパク質の品質を管理する新たなシステムを突き止めました。産生したタンパク質がきちんと機能する正常な立体構造(折り畳み構造)になっているかどうかを監視する小胞体の分子装置が、器官外のサイトゾル(細胞質ゾル)でも連携してチェックしていたもので、高品質の有用なタンパク質の生産効率の向上にも貢献する成果です。
真核生物細胞内には、タンパク質を合成する場所が、大きく分けて 2 つあります。第一に、サイトゾルに浮遊するリボソームでは、細胞内で機能するタンパク質の遺伝情報をコードするメッセンジャーRNA(mRNA)が翻訳され、その産物であるタンパク質はサイトゾルや核で働きます。
第二に、真核生物細胞は小胞体と呼ばれる巨大な袋状オルガネラ(膜構造)を有しており、細胞外に分泌されるタンパク質をコードするmRNA は、小胞体膜に付着したリボゾームにより翻訳されます。そして、その産物タンパク質は小胞体内で折り畳まれた後、細胞外へと運ばれます。さまざまなタンパク質の折り畳みを助けるため、サイトゾルと小胞体は別個に分子シャペロンと呼ばれるタンパク質を有しています。
サイトゾルと小胞体はそれぞれ、タンパク質の折り畳み状態を検知し、修復する仕組みを有しています。小胞体の機能が低下し、折り畳みが不全な変性タンパク質が蓄積する状態が小胞体ストレス(注1)です。真核生物細胞は、小胞体ストレスに応じて小胞体内在性分子シャペロンの量を増加させることが知られており(小胞体ストレス応答 注 2)、その際に小胞体ストレスを感知するセンサーとして働くのが Ire1 と呼ばれるタンパク質です。
一方、高温などにより、サイトゾルにてタンパク質が大量に変性および凝集した場合、サイトゾルで働く分子シャペロンの量が増加します(熱ショック応答 注 3)。
この研究において私たちは、P. pastoris においてIre1 遺伝子を破壊し、その表現型を精査しました。その結果、予想通り、Ire1 遺伝子破壊株では小胞体ストレス応答が起きませんでしたが、さらには、Ire1 遺伝子破壊株は非ストレス条件で培養した場合でも、サイトゾルに変性タンパク質が蓄積し、熱ショック応答が引き起こされていることが分かりました。また、P. pastoris では培養温度の上昇でも Ire1 は活性化し、Ire1 遺伝子破壊株は熱ストレスへの感受性が増大していることも明らかとなりました。
これらの知見は、少なくとも P. pastoris においては、本来は小胞体でのタンパク質折り畳み状態を監視する役割を担う Ire1 が、サイトゾルにおけるタンパク質の品質管理にも関わっていることを示しています。医療用タンパク質を含む数多くのタンパク質が、遺伝子組換え法を利用して、P. pastoris にて製造されています。P. pastoris におけるタンパク質品質管理システムの一端を解明した本研究の成果は、高品質な有用タンパク質の増産にも役立つと期待されます。
この研究成果は、スイス発のオープンアクセス誌「Frontiers in Microbiology」第 14 巻にて 2023年6月20日(火)に公開されました(DOI:10.3389/fmicb.2023.1157146)。
【解説】
動物、植物、酵母を含む真核生物細胞は、さまざまなオルガネラ(小器官)を有し、それ以外の領域がサイトゾルです。小胞体は最も大きなオルガネラであり、一層の生体膜で覆われた袋として存在し、扁平あるいは筒状の形態になって、細胞全体に広がっています。小胞体の表面には多数のリボゾームが付着している場合があり、そのような小胞体は粗面小胞体と呼ばれています。
リボゾームは mRNA にコードされた遺伝情報を翻訳し、タンパク質を合成する装置です。しかし、作られたばかりのタンパク質(あるいは、リボゾームで合成途中のタンパク質)は、折り畳まれていない紐状の形状だと考えられており、そのままでは、機能を発揮できません。そこで、細胞内でさまざまなタンパク質の折り畳みを助けるタンパク質が分子シャペロンです。一方で、正しく折り畳まれなかったタンパク質は、変性タンパク質として凝集し、細胞にダメージを与えます。
単細胞真核生物である酵母は約 6,000 種類のタンパク質を作る遺伝子を持ち、哺乳動物を含む高等真核生物が有するタンパク質の遺伝子は数万種類に上ります。これらの生物が作るタンパク質の多くは、サイトゾルに浮遊するリボゾームにて合成され、サイトゾルに存在する分子シャペロンによって折り畳まれます(図 1)。一方、タンパク質の一部は小胞体に付着したリボゾームによって合成され、小胞体内に運ばれます。そして、小胞体内に存在する分子シャペロンによって折り畳まれ、さらに細胞内を輸送され、細胞外へと分泌される場合もあります(図 1)。
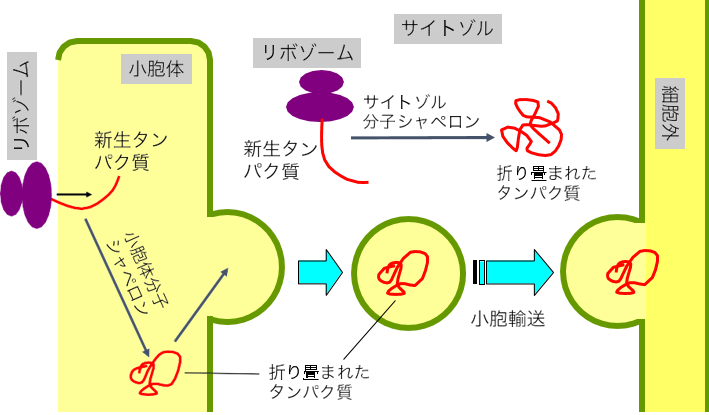
図 1:真核生物細胞内のタンパク質の合成と折り畳み
サイトゾルと小胞体にはそれぞれ、タンパク質の折り畳み状態を監視し、修復するシステムが存在しています。高温ストレスなどに細胞が晒された場合、細胞内のタンパク質が変性します。そして、サイトゾルへの変性タンパク質の蓄積および凝集が引き金となり、サイトゾルで働く分子シャペロンの量が増えます(熱ショック応答)。一方、例えば小胞体に運び込まれるタンパク質が過多で、小胞体の処理能力を超えた時などに、小胞体内に変性タンパク質が蓄積します。この状態は小胞体ストレスと呼ばれ、それに対する防衛応答として、小胞体で働く分子シャペロンの量が増えます(小胞体ストレス応答)。
熱ショック応答も小胞体ストレス応答も真核生物細胞全般に認められる現象であり、そのメカニズムの解明では、パン酵母として知られる Saccharomyces cerevisiae (S. cerevisiae)がモデル生物として用いた研究が進められてきました。S. cerevisiae の小胞体には Ire1 と呼ばれるタンパク質が存在し、小胞体ストレスに応じて活性化します。Ire1 の役割りは、遺伝子を働かせる転写因子のタンパク質 Hac1 の量を増やすことです。Hac1 の役割は小胞体内在性分子シャペロンなどをコードする遺伝子に働きかけることであり、それにより、小胞体内在性分子シャペロンの合成が促されます(図2A)。
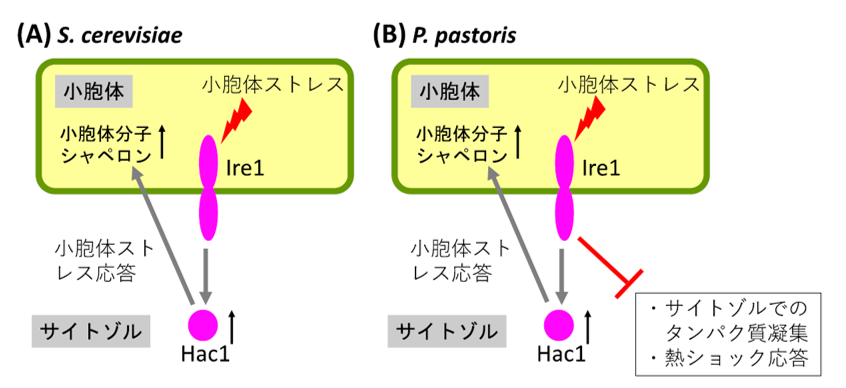
図 2:小胞体ストレスセンサーIre1 の役割
Ire1 は小胞体ストレスに応じて活性化する。(A) S. cerevisiae では、その結果、転写因子Hac1 の発現が誘導され、小胞体分子シャペロンの量が増大する(小胞体ストレス応答)。(B) P. pastoris では、Ire1 はHac1 を介して小胞体ストレス応答を引き起こすとともに、Hac1 非依存的な経路にて、サイトゾルでのタンパク質凝集を防止し、熱ショック応答を抑える。
P. pastoris もIre1 やHac1 を有しています。それらが S. cerevisiae のIre1 やHac1 と同じ機能を有するかどうかを調べるため、今回の研究において私たちは、ゲノム編集技術を用い、Ire1 やHac1 をコードする遺伝子を破壊した P. pastoris 株を作製しました。そして、次世代 DNA シークエンサーを用いた mRNA シークエンス解析により、P. pastoris が有する約 6,000 個の遺伝子のそれぞれがどの程度に発現してるか(約 6,000 種類のタンパク質がそれぞれ、どの程度作られているか)を調べました。その結果、予想通り、S. cerevisiae の場合と同様、P. pastoris の場合も、Ire1 遺伝子や Hac1 遺伝子の破壊により、小胞体ストレス応答が起きなくなりました。
一方、P. pastoris と S. cerevisiae の間では、明確な相違点も認められました。P. pastoris においては、Ire1 遺伝子破壊により、サイトゾルでタンパク質が凝集し、非ストレス条件で細胞を培養した場合も、熱ショック応答が起きたのです。Hac1 遺伝子破壊では、そのような事象は認められません。すなわち、S. cerevisiae の場合と異なり P. pastoris では、Ire1 は Hac1 を介して小胞体ストレス応答を引き起こすだけでなく、サイトゾルのタンパク質凝集を防ぐ役割も担っており、それにはHac1 は関係しないのです(図 2B)。また、P. pastoris においては培養温度の上昇でも Ire1 は活性化し、Ire1 遺伝子破壊によって熱ストレスへの感受性が増大することも示されました。
Ire1 はあらゆる真核生物にて見つかっており、小胞体の機能維持に役立っていることが知られています。私たちの研究では、少なくとも P. pastoris では、Ire1 のサイトゾルにおけるタンパク質の正常性維持にも関わっていることが示されました。すなわち、Ire1 が架け橋となり、サイトゾルと小胞体という異なる細胞内区画におけるタンパク質の品質管理が、有機的に繋がっているのです。
【今後の展開】
P. pastoris はメタノールを栄養源として増殖することができ、メタノール培地で培養した場合、メタノールを代謝するための酵素 Aox1(アルコールオキシダーゼ 1)を大量に合成します。よって、他種生物のタンパク質をコードする遺伝子を Aox1 遺伝子プロモーターに繋いだ DNA を構築し、それを P. pastoris に導入することにより、そのタンパク質を量産することが可能となります。現在、多様な医療用タンパク質(ヒト型インシュリン、アルブミン、コラーゲンなど)が P. pastoris を用いて製造されています。すなわち、遺伝子組換え技術を利用して、さまざまな疾患の治療に必要なタンパク質を、人からではなく、大量培養が可能な酵母から得ることができるのです。
また、P. pastoris における異種タンパク質の産生量や品質の向上のため、遺伝子操作によって Hac1 を大量に発現させることにより、恒常的に小胞体ストレス応答を起こさせ、タンパク質の折り畳み効率を高める試みが行われてきましたが、今回の私たちの研究では、P. pastoris において、Ire1 はHac1 を介した機能以外の役割も担い、細胞内のタンパク質凝集を阻止していることが分かりました。そこで、Hac1 の大量発現に加え、Ire1 遺伝子を改変し、Ire1 の機能を増強することにより、タンパク質の折り畳み効率がさらに高まり、異種タンパク質の産生に資すると期待されます。
【用語解説】
注 1)小胞体ストレス:小胞体の機能不全により、小胞体内に変性タンパク質が蓄積する状態。ヒトでは例えば、ウィルス感染や癌により小胞体ストレスが引き起こされることが知られています。
注 2)小胞体ストレス応答:真核生物細胞全般において引き起こされる、小胞体ストレスからの防衛応答。小胞体内在性分子シャペロンなどの産生量が向上する他、小胞体内に蓄積した変性タンパク質の分解が進みます。
注 3)熱ショック応答:高温ストレスなどにより、細胞内(主としてサイトゾル)に変性タンパク質が蓄積・凝集した際に、サイトゾルで機能する分子シャペロンの産生量が向上する事象。温度変化だけでなく、タンパク質の変性に繋がる化学薬品に細胞が晒されることによっても、熱ショック応答は引き起こされます。
【掲載論文】
タイトル:Endoplasmic stress sensor Ire1 is involved in cytosolic/nuclear protein quality control in Pichia pastoris cells independent of HAC1
著者:Yasmin Nabilah Binti Mohd Fauzee, Yuki Yoshida, Yukio Kimata
雑誌名:Frontiers in Microbiology
DOI:10.3389/fmicb.2023.1157146
【微生物インタラクション研究室】
研究室紹介ページ:https://bsw3.naist.jp/courses/courses313.html
研究室ホームページ:https://bsw3.naist.jp/microbial_interaction/
(2023年06月22日掲載)
