2024.2.1
トランスオミクスで読み解く血糖制御メカニズム
データ駆動型生物学研究室・助教・小鍛治 俊也
- 要旨
- グルコースは生命活動に不可欠な栄養であり、どのような環境でも血糖値(血中グルコース値)を一定に保つシステムが体内に存在しています。このシステムは全身に及ぶ巨大な生体分子ネットワークであり、その全貌はいまだ明らかではありません。トランスオミクス解析は、複数のオミクス解析を組み合わせて大規模な分子ネットワークを構築する手法です。本稿では、トランスオミクス解析により構築された大規模血糖制御ネットワークを通して、私たちの体内にある制御システムいかに複雑であるかを紹介します。
- 主要関連論文
- Kokaji, T., Hatano, A., Ito, Y., Yugi, K., Eto, M., Morita, K., Ohno, S., Fujii, M., Hironaka, K., Egami, R., et al. (2020). Transomics analysis reveals allosteric and gene regulation axes for altered hepatic glucose-responsive metabolism in obesity. Sci. Signal., 13(660), eaaz1236.
doi: 10.1126/scisignal.aaz1236 - Egami, R., Kokaji, T., Hatano, A., Yugi, K., Eto, M., Morita, K., Ohno, S., Fujii, M., Hironaka, K., Uematsu, S., et al. (2021). Trans-omic analysis reveals obesity-associated dysregulation of inter-organ metabolic cycles between the liver and skeletal muscle. iScience, 24(3), 102217.
doi: 10.1016/j.isci.2021.102217
1.はじめに
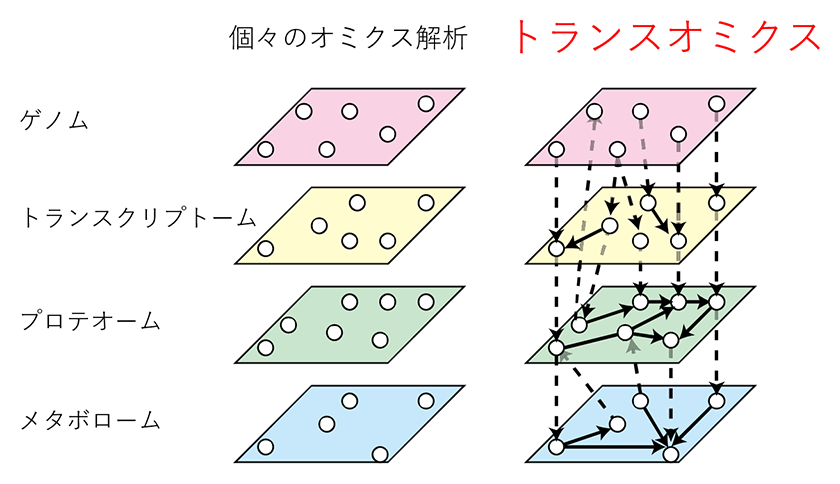
近年、オミクス解析という生体試料内のある種類の分子を同時に多く測定する技術が生命科学分野において使われるようになってきました。例えば、プロテオーム解析はタンパク質(プロテイン)を測定する技術で、 1000種以上のタンパク質を同時測定することができ、例えば疾患による異常をきたすタンパク質リストを明らかにできます。オミクス解析は単体でも多くの情報を取り出すことができますが、組み合せることでより詳細な生体制御メカニズムを明らかにできます。このような解析をトランスオミクス解析と呼びます(図1)(1)。以下では、例としてマウスの代謝制御メカニズムを対象としたトランスオミクス解析をいくつか紹介します。
2.糖投与時のマウス体内の代謝制御ネットワークを解き明かす
私たちは生体活動のためのエネルギーを日々食事から取り込んでいます。特にグルコースは最も重要な栄養の一つで、食事のタイミングに関わらず血中グルコース濃度(血糖値)を一定の範囲に保つ必要があります。そのため私たちの体内には、食事や飢餓など様々な栄養環境に対応するための血糖制御メカニズムが存在しています。食事により得られたグルコースにより血糖値が急激に上昇すると、すい臓からインスリンというホルモンが血中に放出されます。このホルモンは、血液を介して肝臓や筋肉などの臓器に働きかけ、臓器内へのグルコースの貯蓄を促進し、結果として食後2時間程度で血糖値は元の値にかなり近づきます。この血糖制御メカニズムの全容を解明するには、いかにしてインスリンが臓器内のグルコース代謝を変化させたかを明らかにする必要があります。これまでの研究では、インスリンがいくつかのシグナル分子を介して解糖系やグリコーゲン代謝などのグルコースに直接関わる代謝系の一部の代謝酵素の活性を変化させるかが調べられてきました。私たちの研究では、糖投与後のマウスの肝臓に対してトランスオミクス解析を行い、インスリンによる代謝制御ネットワークを大規模に明らかとしました(図2)(2)。その結果、従来の研究通りの代謝酵素の活性制御による糖代謝制御に加え、多くのアロステリック制御(代謝物自身による代謝制御)が見つかりました。また糖代謝だけではなく、アミノ酸代謝など間接的に血糖に関わる代謝もインスリンによる制御を受けることが分かりました。
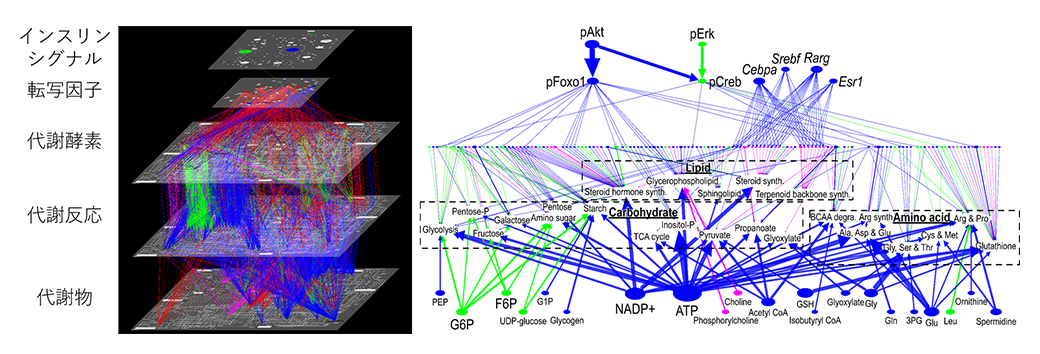
図2.トランスオミクス解析で得たマウスに糖を与えた時の制御ネットワーク。青:健常特異的制御、赤:肥満特異的制御、緑:共通制御。左はネットワーク全体で、代謝酵素による代謝制御(3段→4段)に加え、代謝物による代謝制御(5段→4段)も多く見られる。右は各代謝経路を中心にネットワークをまとめ直したもので、糖代謝(Carbohydrate)に加え他の代謝経路(Amino acidやLipid)への制御も可視化している。
3.肥満による制御の崩れ
血糖制御メカニズムの理解は、実は糖尿病の発症メカニズムの理解につながります。現代では日本人成人男性の4人に1人以上が肥満によるメタボリックシンドロームであるといわれており、この状態が悪化すると2型糖尿病になります。糖尿病とは、血糖値が異常に高い値になってしまう疾患で、様々な合併症を引き起こします。血糖値が高くなる原因は、肝臓や筋肉での脂質蓄積によるインスリン抵抗性です。この状態の臓器には、インスリンが効きづらくなり、糖代謝制御が上手くいかないことが知られています。私たちは、肥満のマウスと健康なマウスの比較トランスオミクス解析を行い、肝臓と筋肉をまたがる制御ネットワークの崩れを明らかとしました(3)。その結果、肝臓におけるアラニン/乳酸からのグルコース産生の増加およびアラニン/乳酸の血液からの取り込みの増加、筋肉におけるグルコース取り込みの減退などの肥満における高血糖の原因となる代謝活性の変化およびそれらの制御経路を明らかとしました。このようなネットワークを拡張していくことで、高血糖の発症メカニズムの全貌が明らかになっていくと思われます。
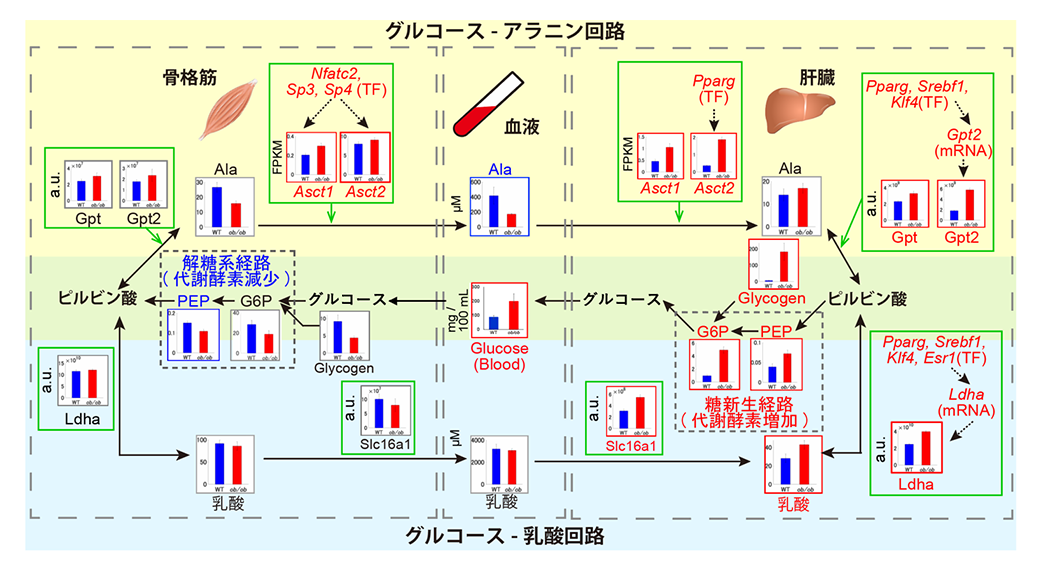
図3.肥満によりグルコース~乳酸やグルコース~アラニンの臓器間サイクルが異常をきたす。黒矢印が代謝の流れを表し、肝臓でアラニン(Ala)や乳酸がグルコースに変換され、筋肉に送られる様子を表している。緑矢印は代謝の流れとそれを制御する代謝酵素を、赤文字/青文字は肥満における各分子の増加/減少を表す。
4.おわりに
今回紹介した研究はマウスの代謝制御を対象としたものでしたが、トランスオミクス解析はあらゆる生物種や現象に適用することができます。また個々のオミクス解析自体が発展途上の技術であり、実際エピゲノム解析など新規のオミクス解析の統合にも取り組んでいます(4)。従ってトランスオミクス解析は多くの調査・勉強を要する研究になりますが、同時にそれが魅力であるとも思います。今後もオミクス解析を利用した生命現象の理解を目標に研究を進めていきます。
参考文献
小鍛治 俊也 NAIST Edge BIO, 0021. (2024)