機能ゲノム医学研究室(石田研究室)
Functional Genomics and Medicine
研究内容 Research
PD-1の生理機能の解明(石田准教授)
今明かすPD-1発見の舞台裏–– みんなつながっているんだよ ––
「PD-1は偶然発見された」と言われますが、私は少し違ったとらえ方をしています。今回のストーリーには多くの人や研究が登場し、それぞれユニークな役割を果たします。その結果、PD-1は必然的に発見されたのです!
サブトラクション法との出会い
1982年初夏、私は名古屋大学医学部の学部1年生(2年間の教養課程を終え、専門課程に進学したばかりの学生)でした。同級生の笹岡俊邦君(現・新潟大脳研)から名大祭の学年企画「臓器移植の現状」を取りまとめるよう指示され、その準備の過程で、この世に免疫拒絶反応という厄介なものが存在することを知りました。その後、私は免疫細胞による自己と非自己の識別機構に魅了され、気がつけば、愛知県がんセンター研究所(高橋利忠先生と上田龍三先生の研究室)にほとんど住みついて、モノクローナル抗体づくりに没頭していました。
1983年8月に京都にて第5回国際免疫学会が開催され、そこでスタンフォード大のMark M. DavisがT細胞抗原受容体(TCR)遺伝子のクローニングに成功したと公表したため、免疫研究者のコミュニティーに大きな衝撃が走ります。その研究成果は1984年3月のNature誌に、M. M. Davisのグループ(1, 2)とTak W. Mak(トロント大)のグループ(3)の3本のArticle論文として発表されました。長い間謎に包まれていたTCRの実体は、抗clonotype抗体を用いてTCR分子を精製するという正攻法を採用したグループではなく、どこからともなく彗星のように登場したM. M. DavisとT. W. Makの二つのグループによって、あっと言う間に解明されてしまったのです。
この二つのグループが採用したエレガントな戦略が、cDNAのサブトラクション(引き算)法でした。これは「溶液中の核酸のハイブリダイゼーション」と「ハイドロキシアパタイト・カラムを利用した1本鎖核酸と2本鎖核酸の分離」を巧妙に組み合わせた技術で、この手法を用いれば、片方の細胞では発現しているが、他方の細胞では発現していない、という遺伝子を高度に濃縮することができます。愛知県がんセンター研究所の図書室で彼らのNature論文を読んだ22歳の私は、「自分も分子生物学の研究者になって、いつか必ずサブトラクション法を成功させてやるぞ!」と心に誓いました。
柳先生との出会い
TCR遺伝子の衝撃的な発見から間もなく、T. W. Mak論文(3)の筆頭著者・柳雄介先生(現・九州大学医学部)は、東京大学医学部免疫学教室(多田富雄教授)に助手として赴任されることになりました。それを知った名大理学部・助手の黒沢良和先生(現・藤田学園保健衛生大学)は、さっそく柳先生の特別セミナーを名大で計画され、私にも柳先生のセミナーに参加するよう、声をかけて下さいました。
セミナー当日、私は開始時刻の30分以上も前に会場に到着してしまったのですが、そこにはすでに、とても真面目そうな青年がぴんと背筋を伸ばして一人で物静かに座っていました。実はその人がトロントで偉業を達成されたばかりの柳先生だったのです。柳先生と私は、がらんとした小さな教室で向き合って座る格好になり、その場の沈黙に耐えきれず、少しずつ会話を始めました。この日の出会いをきっかけに、私は事あるごとに柳先生に様々な質問をぶつけることになるのですが、柳先生はいつも真摯に答えて下さいました。
本庶研での出会い
時は流れ、1986年3月、講義にほとんど出席しなかった私も何とか大学を卒業でき、愛知県がんセンター病院(血液化学療法部)での1年間の臨床研修のあと、1987年の春、京都大学医学部医化学教室の本庶佑先生のグループに大学院生として加えていただくことになりました。名古屋の田舎者にとって本庶研はすばらしいopportunityが無限に広がる夢のような異次元空間で、さぞ同期の研究者も多いと思っていたのですが、その年は京大医学部出身の田代啓さん(現・京都府立医大)と大阪大学医学部出身の斉藤雄二さん(故人)のたった二人だけでとても驚きました。
本庶研に大学院生として入門後も、私の頭の中には「T細胞による自己と非自己の識別」と「サブトラクション」の二つのキーワードが居座ったままでした。しかし、研究室に入ったばかりの大学院生が好き勝手に実験系を組み立てて研究することなどもちろんできません。まず、私に課せられた任務は、西(竹島)美幸さん(現・京大薬学部)が苦労して樹立したヒトIL-2やIL-2受容体(Tac/p55/鎖)トランスジェニックマウスに現れる免疫異常を解析するというものでした。当時、Dana-Farberがん研究所のEllis L. Reinherzらは、胸腺細胞(未熟T細胞)におけるIL-2シグナルの有無が胸腺細胞の運命を決定するというPNAS論文を発表しており(4)、私はIL-2/IL-2受容体トランスジェニックマウスの実験系も、ひょっとしたらT細胞による自己−非自己識別の分子機構を理解するために役立つかも知れないと考え、連日、日付が変わるまで実験に熱中しました。
本庶先生とのディスカッション
しかし、私がいくらトランスジェニックマウスの研究に打ち込んでも、もう一方の「サブトラクション」が実現に近づくことはありません。私は低学年の大学院生という立場も顧みず、本庶先生にたびたびディスカッションを持ちかけました。当時はまだRAG1やRAG2が見つかっていなかったので、本庶研を含む世界の有力グループが、免疫グロブリン遺伝子やTCR遺伝子の再構成に必要な「recombinase」の実態を必死で探索していました。
「Recombinase」遺伝子を単離・同定するためには?
- TCR遺伝子の再構成が起きる胸腺には存在するが、成熟したT細胞には存在しないmRNA (cDNA)をサブトラクションで濃縮し、cDNAライブラリーを作製する。
- 免疫グロブリン遺伝子の再構成を低頻度ながら引き起こすことが可能なpre-B細胞株には存在するが、成熟したB細胞には存在しないmRNA (cDNA)をサブトラクションで濃縮し、mixed cDNAプローブを用意する。
- このmixed cDNAプローブで上記のcDNAライブラリーをスクリーニングすれば、きっと「recombinase」の遺伝子を単離することができる!
私がこの仮説を提案すると、本庶先生は大きくため息をつかれ、「石田君、君のアイディアは面白い。しかし、そのストラテジーはあまりにも多くの楽観的な仮定に基づいていませんか。例えば、候補遺伝子がたくさん見つかった場合、君は一体どうやってそれを絞り込むんや?」とおっしゃいました。先生からそう指摘され、私はただただ沈黙するしかありませんでした。
T細胞のアポトーシス
1988年春、西さんはカリフォルニアのスクリプス研究所へ留学されました。私の前には膨大な数のヒトIL-2あるいはIL-2受容体トランスジェニックマウスが残され、たった一人でそれらを維持し、解析するのは本当に大変でした。ただラッキーなことに、田口修先生(愛知県がんセンター研究所)、稲葉カヨ先生(現・京大生命科学)、湊長博先生(現・京大医学部)から強力なサポートを得て、私は学位取得に必要な論文を1989年の夏までに何本か書き上げることができました。
ヒトIL-2あるいはIL-2受容体トランスジェニックマウスの解析が一段落したころ、研究の世界では、プログラム細胞死(programmed cell death)やアポトーシス(apoptosis)という用語があちこちで話題になり始めていました。1989年1月にはイギリスのグループが、胸腺細胞を抗TCR/CD3抗体で刺激するとアポトーシスで死滅するという論文をNatureに発表し、免疫学研究者を強烈にインスパイヤーします(5)。その後、胸腺細胞だけでなく、マウスのT細胞ハイブリドーマもTCR/CD3への刺激でアポトーシスを引き起こすこと、TCR/CD3刺激によって誘導された胸腺細胞やT細胞ハイブリドーマのアポトーシスには、de novoの遺伝子発現が必要であることなどが次々に明らかにされ、私の興奮は頂点に達しました。なぜならば、TCR遺伝子のランダムな再構成の結果、たまたま自己反応性を獲得した胸腺内の未熟T細胞は、自らが生体にとって厄介者であることを察知して、何らかの「必須遺伝子」を新たに発現することにより、アポトーシスで自殺する道を選ぶ、というストーリーが考えられたからです。私にはその「必須遺伝子」こそが、T細胞による自己−非自己識別の分子機構の中で決定的な役割を果たすものに思われました。また、そのように新しく発現が誘導される遺伝子ならば、M. M. Davisや柳先生が成功させたサブトラクション法によって、高度に濃縮することができるに違いないと私は確信しました。
最初のハードルは本庶先生の説得でした。T細胞ハイブリドーマの刺激後と刺激前で、ただ単純にサブトラクションを実行するだけでは、細胞死に深く関与する遺伝子以外にも、IL-2などの活性化遺伝子(activation genes)が山ほど濃縮されてしまうことが予想されるので、ストラテジーには「もう一工夫」が必要でした。そこで私は、培地からの増殖因子の除去によってアポトーシスを引き起こす細胞株でもサブトラクションを行うことを考えました。というのも、この細胞株のアポトーシスでもde novoの遺伝子発現が必要になるのではないかと予想されていたからです。刺激されたT細胞ハイブリドーマと増殖因子を除去された細胞株の両者で共通して発現が上昇する遺伝子をサブトラクションで濃縮すれば、かなり高度な絞り込みを達成することができるに違いありません。私がこのアイディアを本庶先生に提案したところ、学位取得のための論文はすでに何本か出していたこともあり、いつも厳しい本庶先生も「まあ、いいか」という感じでOKして下さいました。
待望のサブトラクションとPD-1
待ちに待ったサブトラクションのチャンス到来です。私はまず柳先生にお願いしてトロント時代のサブトラクションのプロトコールを教えていただきました。次に私は千葉大学の斉藤隆先生(現・理研/阪大)から折り紙つきのT細胞ハイブリドーマ2B4.11をいただきました。毎晩遅くまで実験につき合い、私が落ち込んでいる時にも常に明るく励ましてくれたのは、本庶研の3年後輩・縣保年君(現・滋賀医科大学)でした。私はラジオアイソトープ実験棟に張り付くようにして、摂氏60度に保ったハイドロキシアパタイトのカラムにサンプルを流し続け、分離したcDNAでgt10のライブラリーを作製し、プラーク・ハイブリダイゼーションによるスクリーニングを1次、2次、3次へと進めて行きました。
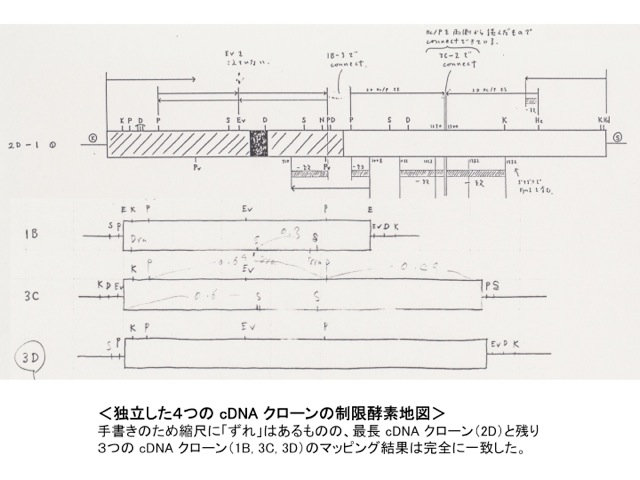
1991年9月、30歳になったばかりの私は、このサブトラクション実験により、4個の独立したcDNAクローンを得ることができました。当時は現在ほど気軽にシークエンシングを行える状況ではなく、未知のDNAクローンが得られたら、何よりも先に制限酵素地図を作製していました。その時も常法に従い、4個のcDNAクローンのマッピングを行いましたが、実験結果を整理して制限酵素地図を再構成した縣君と私は小さな感動を覚えました。4個のcDNAクローンはそれぞれ異なる長さだったものの、その制限酵素地図は完全にオーバーラップしていたのです(図)。つまり、cDNAクローンとしては4種類のものが単離されましたが、私と縣君が行ったサブトラクション実験で最後に残った遺伝子は、信じられないことにたったの1個だったのです。私はその事実に何か運命的なものを感じました。そして新しく発見された遺伝子をPD-1 (programmed death-1)と名づけ、1992年11月にEMBO Journal誌に発表しました(6)。
PD-1研究の発展
今から思えば、PD-1は本当に幸せな遺伝子です。1993年に私がハーバード大へ移ってからも、本庶先生や湊先生の指導のもと、縣保年君、篠原隆司君(現・京大)、西村泰行君(現・滋賀県立成人病センター)、岡崎拓君(現・徳島大学)、岩井佳子さん(現・産業医科大学)、竹馬俊介君(京大)らによって、PD-1は大切にそして正しく育てられました。アメリカのベンチャー企業と共同で抗PD-1抗体の完全ヒト化を推進したのも、本庶研で私と同期だった小野薬品工業の柴山史朗さんです。
私はT細胞による自己−非自己識別機構の本質に迫りたいと思い、多くの研究者との関わりの中でサブトラクション実験を行い、たったひとつのPD-1遺伝子にたどり着きました。そのPD-1が、私が考えていたとおり、自己−非自己識別機構の中で中心的役割を果たすものかどうかは議論の分かれるところです。しかし少なくとも、がん細胞や慢性感染症を引き起こすウイルスは、宿主T細胞が有する自己と非自己を識別する能力を攪乱するために、好んでPD-1を標的にするということは、どうやら間違いないようです。
二十数年前、私はこうしてPD-1に巡り会いました。「様々な研究や論文、そして多くの人たちは、みんなつながっているんだよ!」これが私から皆さんへのメッセージです。
文献
- Hedrick, S.M., et al. Nature 308, 149-153, 1984.
- Hedrick, S.M., et al. Nature 308, 153-158, 1984.
- Yanagi, Y., et al. Nature 308, 145-149, 1984.
- Ramarli, D., et al. PNAS 84, 8598-8602, 1987.
- Smith, C.A., et al. Nature 337, 181-184, 1989.
- Ishida, Y., et al. EMBO J. 11, 3887-3895, 1992.
(このエッセイの内容は、秀潤社が発行する月刊誌「細胞工学」の2014年10月号に掲載されたものと同一です。同誌編集部の許可を得て、ここに転載しました)
