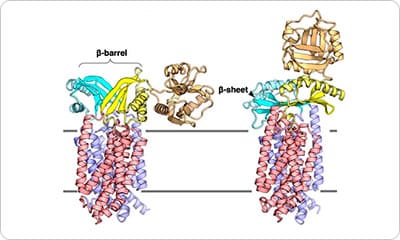
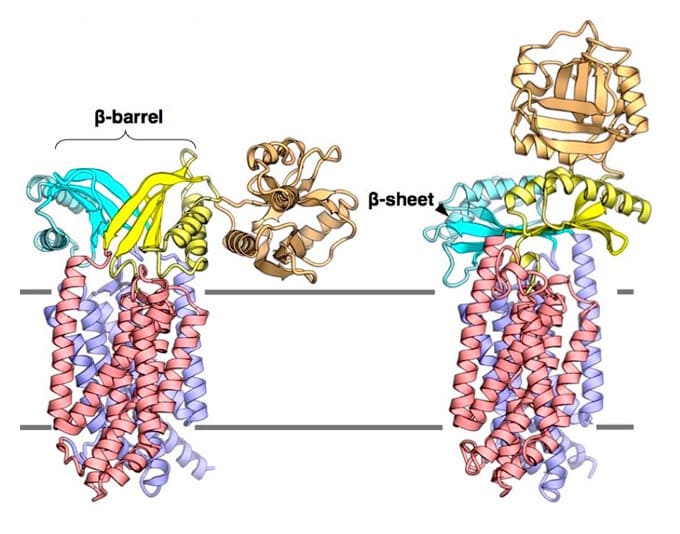
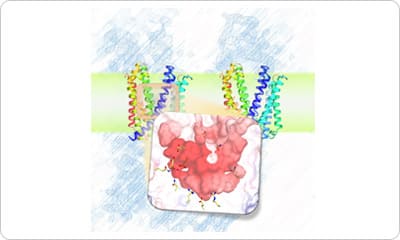
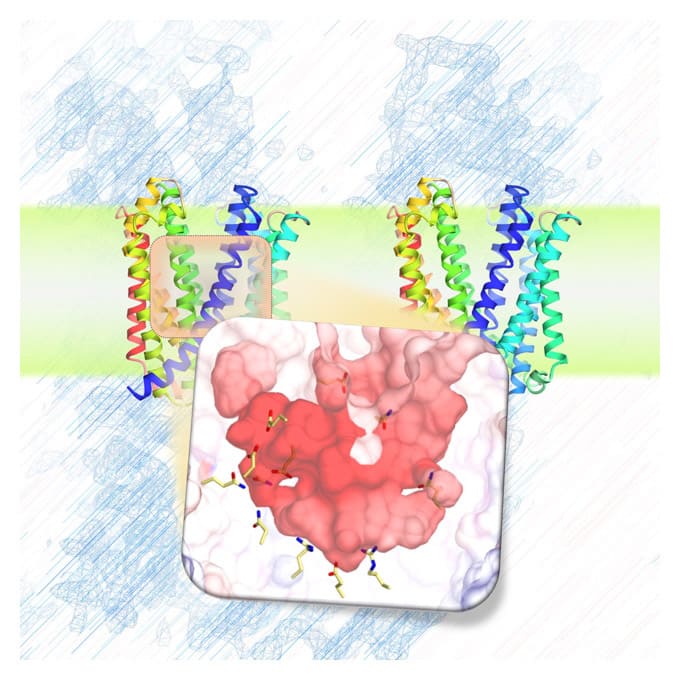
MurJとLysMの複合体の構造解析
ウイルス由来のペプチドが細菌の生命必須の装置を止める仕組みを解明
〜薬剤耐性菌克服への重要な手掛かり〜
解説を読む
AIによる解説を見る
原著論文:Kohga H, Lertpreedakorn N, Miyazaki R, Wu S, Hosoda K, Tanaka H, Takahashi YS, Yoshikaie K, Kuruma Y, Shigematsu H, Mori T and Tsukazaki T Phage lysis protein LysM acts as a wedge to block MurJ conformational changes. Sci. Adv. 11, eady8083 (2025)

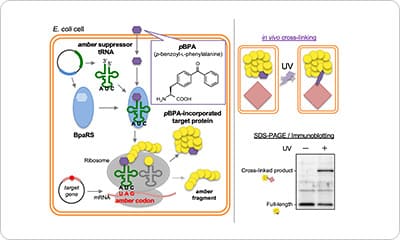
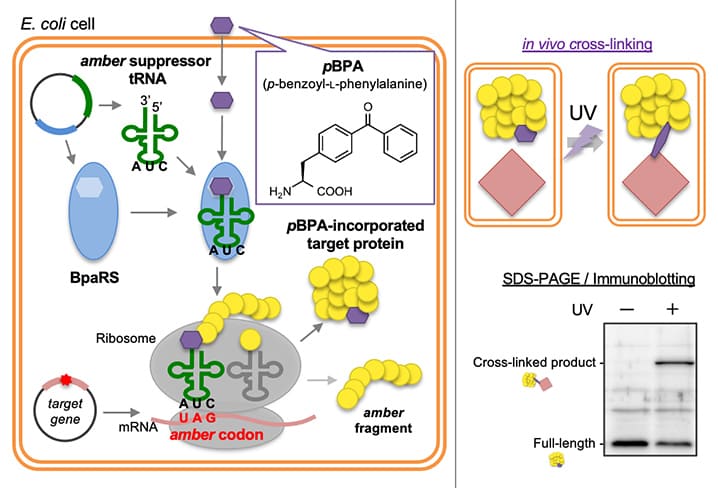
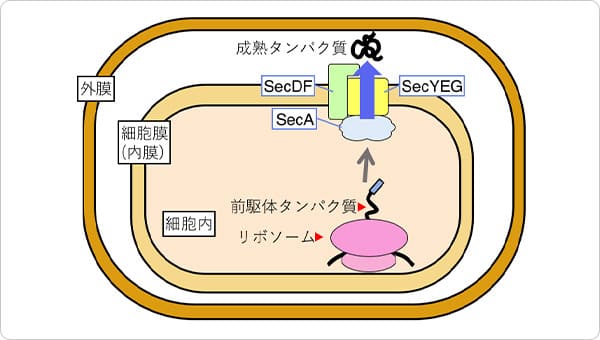
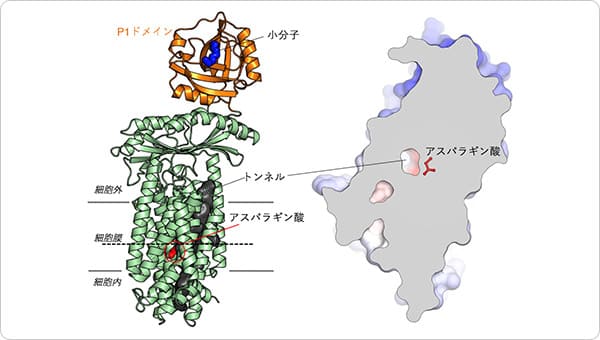
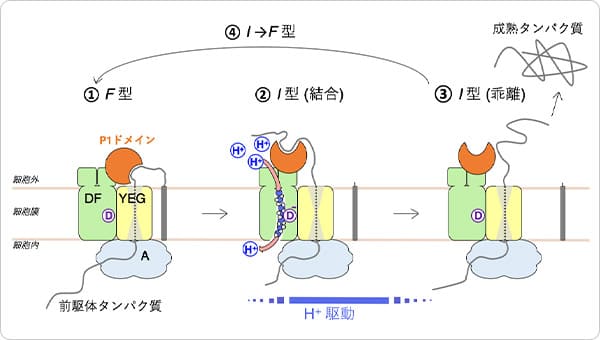
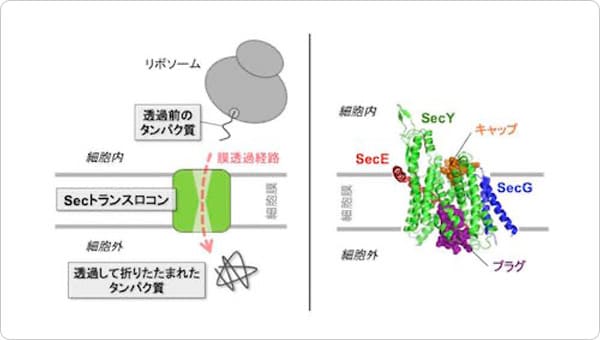
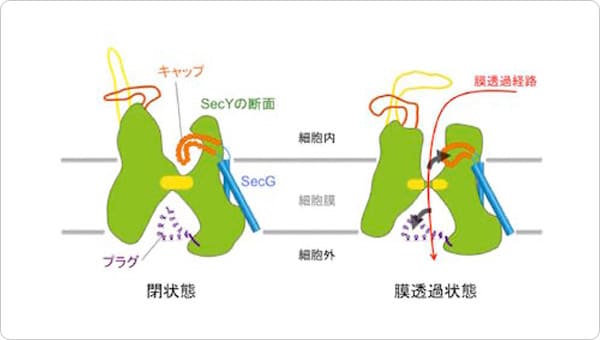
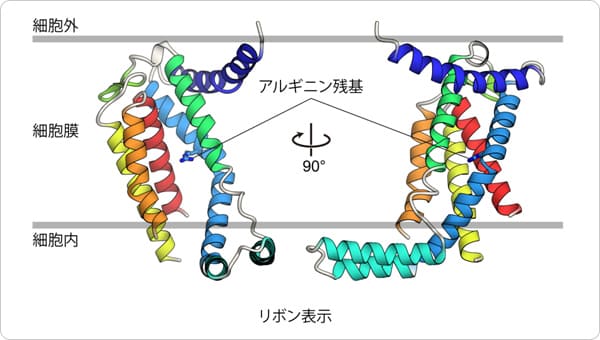
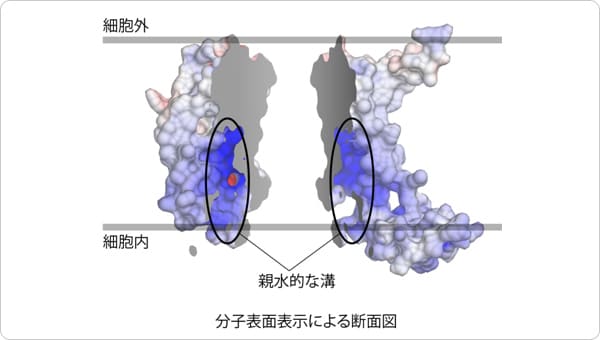
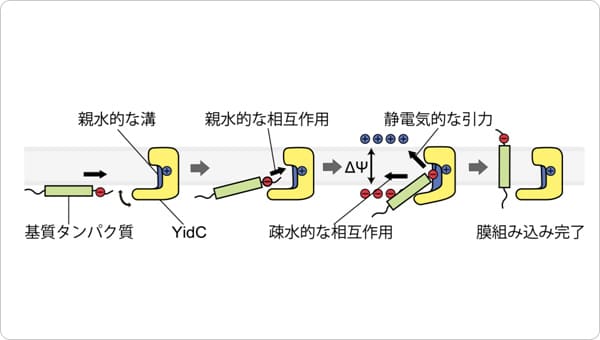
ポイント