効率的なターミネーターの探索
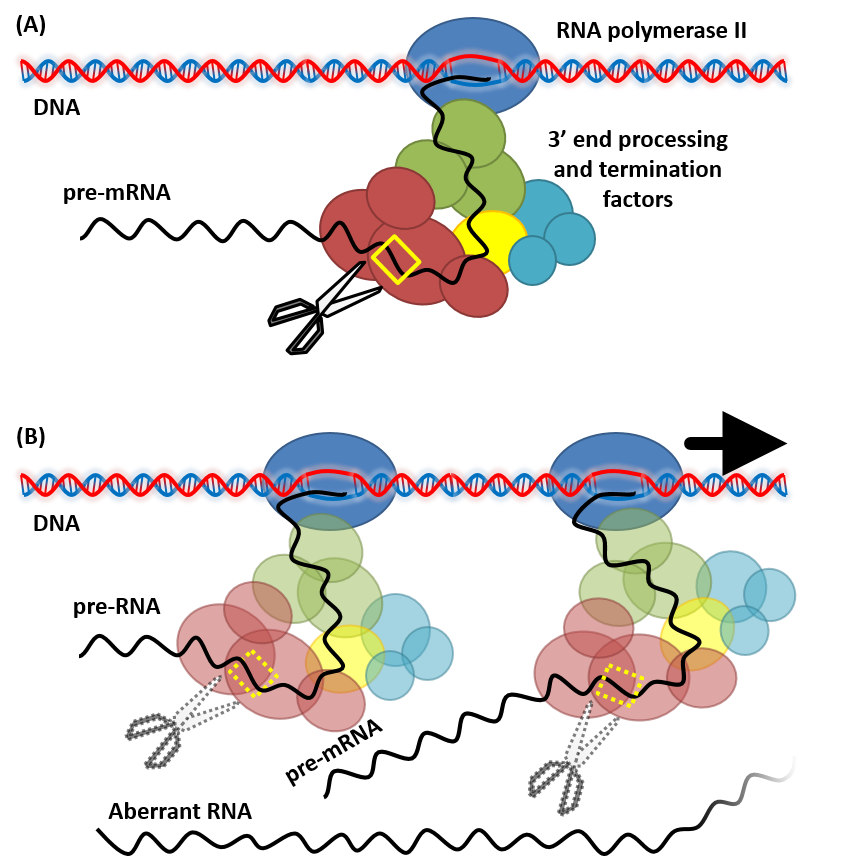
以前、我々はNOSターミネーターよりも効率的な HSP18.2遺伝子由来のターミネーターをシロイヌナズナより見出しました。 レポーター遺伝子の発現を指標に比較すると、約2倍の発現上昇が認められ、転写干渉も緩和しました。 現在、このターミネーターは、多くの研究機関/企業において種々の植物種で外来遺伝子発現に活用されています。 また、HSPターミネーターのより長い領域を用いると、外来遺伝子を 核ゲノムへ挿入した場合に更なる発現上昇が期待できます。 こちらのHSPターミネーターは、タカラバイオ社からpRI201 DNAシリーズとして市販されています。 (リンク)
近年、Nanoporeロングリードシーケンサーを用いることで、poly A 付加部位を網羅的に解析することが可能となりました。 polyA付加部位の網羅的なデータを利用し、更に効率的なターミネーター配列を設計する研究を行っています。 さらに、高等植物から得た知識を活かして、藻類や酵母を対象した効率的なターミネーターの探索も行っています。
mRNA翻訳の効率化
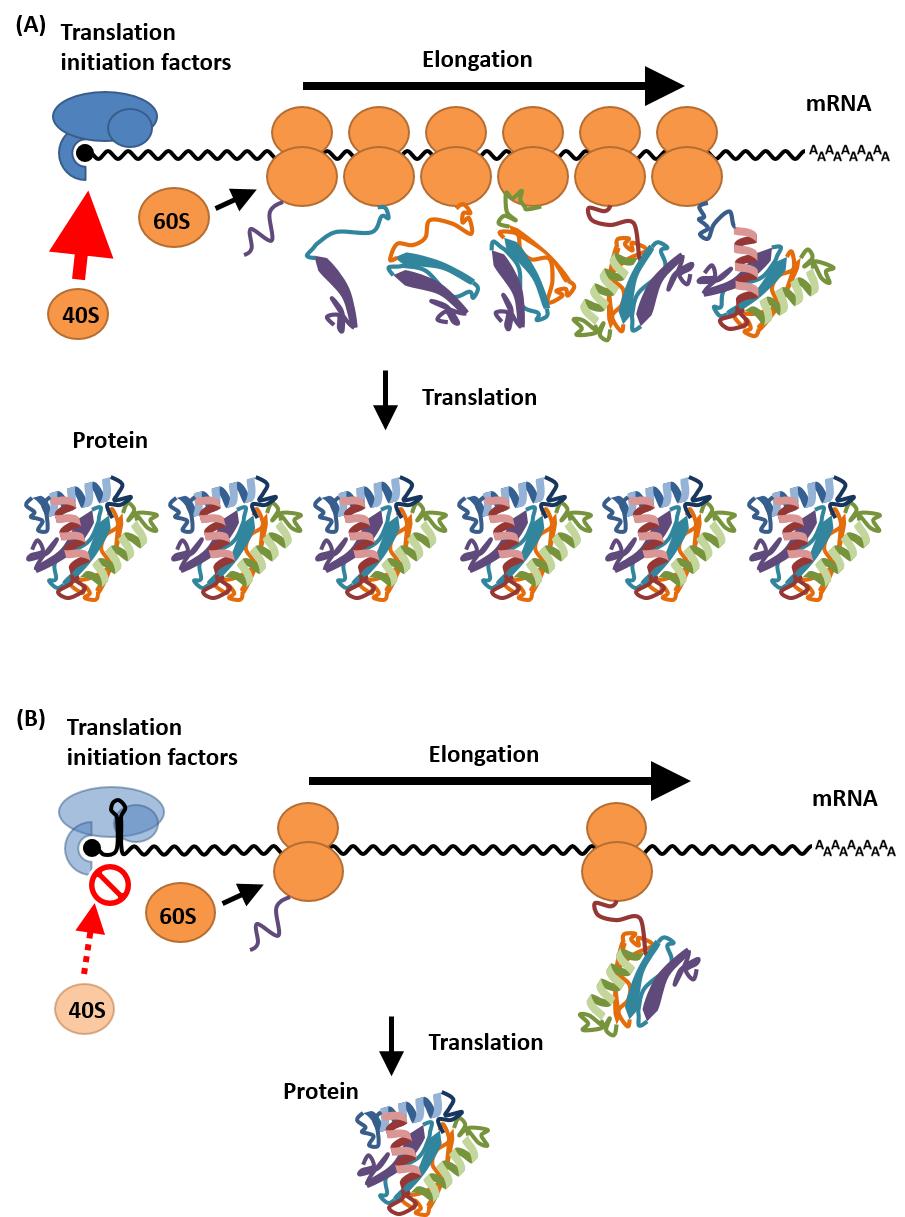
5'UTRの配列と、翻訳効率
遺伝子の発現において重要な過程の一つがmRNAからタンパク質への翻訳です。 mRNAの転写や分解が、mRNAの蓄積量を決めるのに対し、翻訳はmRNAあたりに作られるタンパク質量を決めるため、 翻訳効率を向上するとその生産量が向上します。 真核生物の翻訳開始機構は、CAP構造を介したスキャンニングモデルであり、タンパク質合成の速さは、 5'UTRが仲介する「開始反応」で決まると考えられています。 翻訳開始因子群による40Sリボソーム(正確には43S複合体)の5'UTR領域へのリクルートが翻訳効率を決め。 高効率でのリクルートが可能な場合、 mRNAはポリソームを形成し活発な翻訳が行われ、 単位mRNAあたりに多くのタンパク質を合成することができます(図A)。 一方、5'UTR領域に強固な二次構造を有し、リボソームのリクルートが阻害され、低頻度でしかリクルートされない場合など、 mRNAあたりのタンパク質合成量は低くなってしまいます(図B)。そのため、同じタンパク質を翻訳する場合(CDS配列が同じ)でも、 5'UTRの配列が異なれば、最終的なタンパク質生産量には大きな差が生じます。翻訳エンハンサーによる発現量の向上
特に、翻訳を向上させる5'UTR配列は翻訳エンハンサーと呼ばれ、 当研究室では植物で非常に強力な翻訳エンハンサーを見出しており、 導入遺伝子の発現量を劇的に向上させることに成功しています。 まず、発見された翻訳エンハンサーはアルコールデヒドロゲナーゼ遺伝子の5'UTR(ADH-5'UTR)です。 シロイヌナズナ由来のAtADH-5'UTRとタバコ由来のNtADH-5'UTRは広く双子葉植物で効果が認められ、 既存のpBI系列と比較して約100倍もレポーター遺伝子の発現量を向上させます。 また、イネ由来のOsADH-5'UTRも、単子葉植物で広く発現上昇効果が認められました。 これら翻訳エンハンサーは、植物での効率的な発現カセットの一部として商品化されており、 タカラバイオ社からpRI201 DNAシリーズとして市販されています。 (リンク)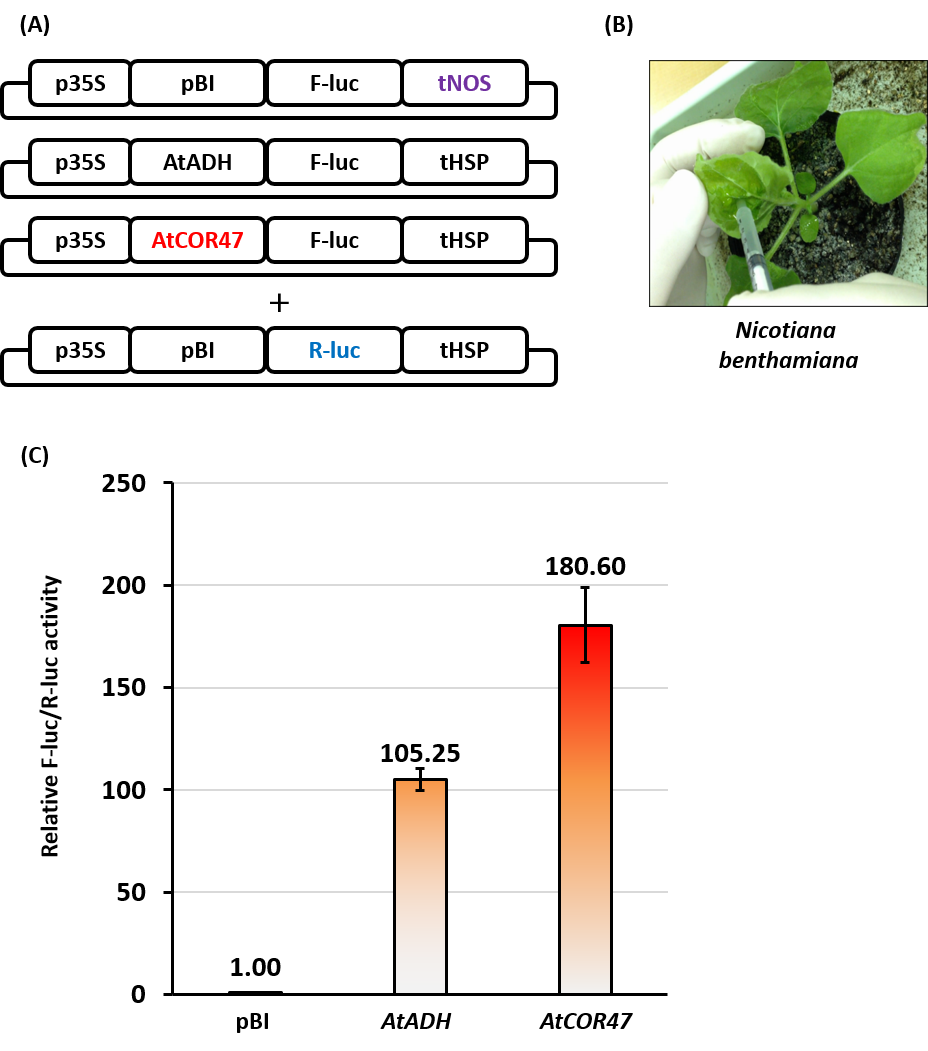
ストレス環境でも抑制を受けない翻訳エンハンサー
翻訳は細胞が置かれた条件によって変化し、特にストレス環境下や成熟した細胞の大部分が劇的な翻訳抑制を受けます。 培養細胞を用いて有用物質の生産を行う場合、高密度培養による低酸素や飢餓ストレスなど、翻訳が抑制されやすい条件を余儀なくされます。 また、植物体を用いる場合、 大きく成長した葉での生産量が求められるが、成熟した細胞での翻訳は抑制されがちです。 このような条件間での翻訳効率の変化にも5'UTR配列は関わっており、 翻訳が抑制される条件下でも活発な翻訳を行う適切な5'UTR配列を用いると、生産量を向上させることが可能となります。そこで、 様々な条件下での翻訳効率を網羅的に評価し、どの条件下でも活発な翻訳が可能な翻訳エンハンサーの探索を行いました。 その結果、双子葉植物に対して非常に強力な効果を有するAtCOR47-5'UTRが見出されました。 この翻訳エンハンサーは、既存のpBI系列の発現カセットと比較して約180倍、前述したAtADH-5'UTRと比較して 約1.8倍もレポーター遺伝子の発現量を向上し(図)、 様々な条件下でも翻訳効率が抑制されないことが形質転換体を用いた発現実験にて確認されています。 なお、ADH-5'UTRは、 発達した組織では若干抑制される傾向があります。 このAtCOR47-5'UTRは、 特許第6607616号として特許化されています。ただし、AtCOR47-5'UTRは単子葉植物のイネでは全く機能せず、逆に翻訳を抑制します。
そこで、単子葉植物でも環境ストレス下での翻訳効率の網羅的な解析を行い、 ストレスによる翻訳抑制を回避できる単子葉機能型翻訳エンハンサー配列を多数取得し、 WO2019/198724として国際特許出願されています。