2023.10.02
細胞膜の中で働く特殊なタンパク質分解酵素の新たな機能
構造生命科学研究室・奈良先端大 特任研究員[日本学術振興会特別研究員(PD)]・横山 達彦
- 要旨
- 膜内切断プロテアーゼは、細胞膜中という疎水的な環境で、タンパク質を切断する特殊なプロテアーゼ(タンパク質分解酵素)です。RsePは大腸菌の膜内切断プロテアーゼの一つですが、切断を受ける基質タンパク質の全体像は分かっていません。筆者らはRsePが切断する未知の生理基質を探索し、RsePが①一回膜貫通タンパク質FecRの切断を介して、細胞の鉄取り込みの制御に関与すること(1)、②幾つもの低分子膜タンパク質(SMP; Small Membrane Protein)を切断し、その機能を制御しうること(2)を最近明らかにしました。
- 主要関連論文
- Yokoyama T, Yamagata Y, Honna S, Mizuno S, Katagiri S, Oi R, Nogi T, Hizukuri Y, and Akiyama Y. (2023) S2P intramembrane protease RseP degrades small membrane proteins and suppresses the cytotoxicity of intrinsic toxin HokB. mBio, e0108623.
https://journals.asm.org/doi/10.1128/mbio.01086-23 - Yokoyama T, Niinae T, Tsumagari K, Imami K, Ishihama Y, Hizukuri Y and Akiyama, Y. (2021) The Escherichia coli S2P intramembrane protease RseP regulates ferric citrate uptake by cleaving the sigma factor regulator FecR. J. Biol. Chem. 296, 100673.
https://www.jbc.org/article/S0021-9258(21)00462-2/
1.はじめに:大腸菌が持つ膜内切断プロテアーゼRseP
生体膜には数多くの膜タンパク質が存在しており、エネルギー生産や外界との物質・情報のやりとり等、多彩な生体反応を担っています。これら膜タンパク質の機能や量は、外界の環境や細胞の状態に応じて適切に制御されています。このような制御のメカニズムには不明な点が多く残されていますが、近年の様々な研究成果から、プロテアーゼによる膜タンパク質の切断・分解が、その重要な⼀翼を担っていることが明らかにされつつあります。
膜内切断プロテアーゼは、水がほとんど存在しない細胞膜中で、水を必要とするタンパク質加水分解(切断)を行うユニークなプロテアーゼです(3)。ヒトから細菌に至るまでほぼ全ての生物種が膜内切断プロテアーゼを持っており、コレステロールの代謝やストレス応答等、様々な生体イベントで重要な役割を果たしています。それらの中でも筆者らは、大腸菌が持つ膜内切断プロテアーゼの一つであるRsePを対象として研究を進めてきました。RsePはこれまでに2つの機能を有することが報告されてきました(図1)。1つ目は、熱などの細胞表面でのストレスに対する応答(表層ストレス応答)の制御です。RsePは一回膜貫通タンパク質であるRseAの切断を介して、細胞表層から細胞内へのストレス情報の伝達に必須な役割を果たします(4)。2つ目は、シグナルペプチドの分解です。分泌タンパク質は、N末端にシグナルペプチドと呼ばれるペプチドを持ちますが、膜を超えて輸送される際に切断されて膜に取り残されます。RsePは、細胞にとって不要なこのシグナルペプチドを分解・除去する、いわば膜の「お掃除屋さん」として働くことが示唆されています(5)。
このように、多様な膜貫通配列を切断することが見出されてきたことで、RsePはこれまで明らかになっていた以上に、様々な膜タンパク質を切断する可能性が浮かび上がってきました。そこで筆者らは、異なる2つのアプローチにより、RsePが切断する新たな基質を探索・同定することで、RsePの細胞内機能の理解を深めることを目指しました。
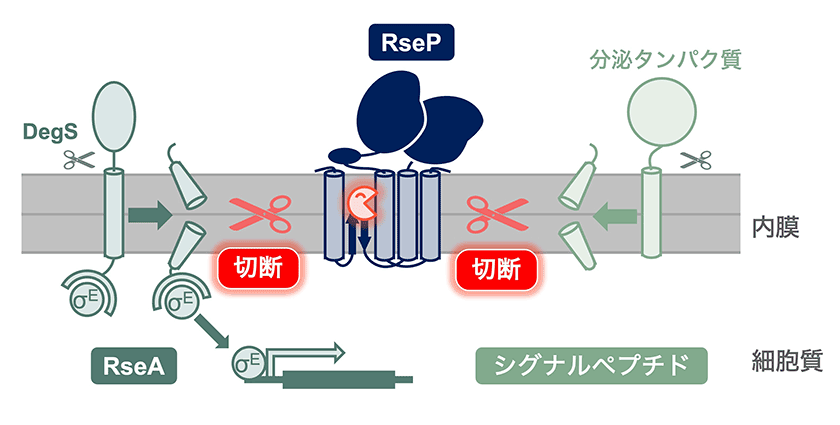
図1.大腸菌膜内切断プロテアーゼRsePの既知の生理機能
RseAは細胞表層のストレスに応答して、膜結合型プロテアーゼDegSにより膜外領域が切断される。RsePは、これにより生じたRseA分解中間体を特異的に認識し、膜内部で切断する。RseAの細胞質領域には、σ因子(転写因子)であるσEが結合している。RsePによる切断を受けて生じたRseAの細胞質側断片は、σEを結合したまま膜から遊離し、細胞質プロテアーゼによって更なる分解を受ける。このようにして最終的にRseAから解放されたσEは、表層ストレス応答に関連する多数の遺伝子の転写を活性化する。またRsePは、分泌タンパク質の膜透過に伴って膜に取り残されるシグナルペプチドを切断する。シグナルペプチドの膜中への蓄積は、膜ストレスの一因ともなり得るため、RsePは膜ストレスの軽減にも寄与していると考えられる。
2.RsePの新奇機能①:鉄取り込みの制御
まず筆者らは、プロテオミクス解析と呼ばれるタンパク質の網羅的な解析手法を用いることで、RsePのプロテアーゼ機能に依存して細胞内の蓄積量が変化するタンパク質を探索しました。その結果、Fecシステムと呼ばれる鉄取り込み装置を構成するタンパク質群の細胞内蓄積量が、RsePが機能できない時に低下することを見出しました。鉄は生物にとって必須な元素であるため、細菌はFecシステムをはじめとして、鉄を細胞内に取り込む様々な装置を有しています。筆者らは、一回膜貫通タンパク質であるFecRが、これらのFecシステムタンパク質をコードする遺伝子群の転写を制御しているとの先行研究に着目し、RsePがFecRを切断することで、Fecシステムの発現制御に関与している可能性を考えました。そこでFecRの細胞内動態を詳細に調べた結果、FecRは(i)まず自己切断し、(ii)さらに鉄シグナルがトリガーとなって2段階目の切断を受け、(iii)続けてこれをRsePが膜中で切断し、(iv)その結果生じた切断断片が、Fecシステムを構成する遺伝子群の転写活性化を誘導していること、を突き止めました(1)(図2)。本成果は、RsePがFecRの切断を介して、細胞の鉄取り込みの制御に関与するという新たな生理機能を明らかにしたものです。また、大腸菌Fecシステムは尿路感染症や牛乳房炎の感染・発症に関与することが報告されているため、本成果はそのメカニズムの解明や治療に貢献しうるものでもあります。
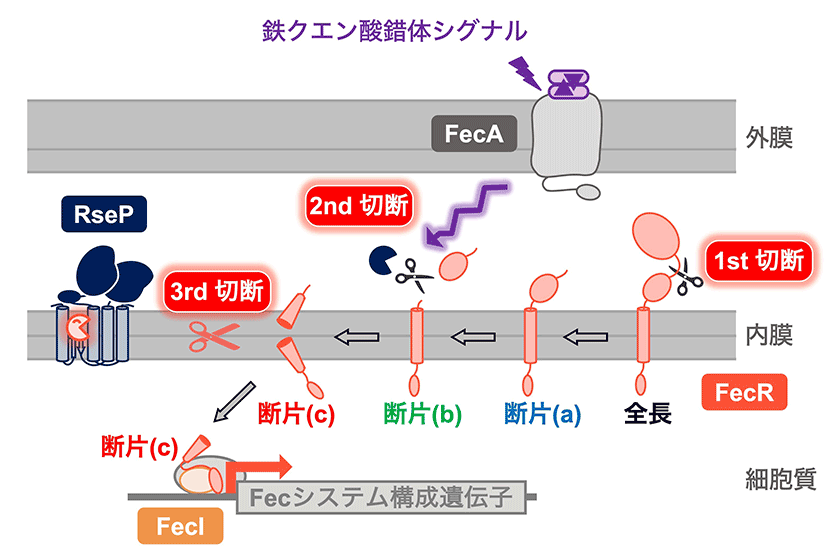
図2.RsePはFecRの切断を介して、細胞の鉄取り込みを制御する
(i) FecRは翻訳直後に自己切断を受け(1st 切断)、断片(a)が産生する。(ii) 断片(a)は未知のプロテアーゼにより切断、またはトリミングされ(2nd 切断)、断片(b)が産生する。この反応は、鉄クエン酸錯体シグナルによって促進される。(iii) 断片(b)は膜内でRsePにより切断され(3rd 切断)、断片(c)に転換される。(iv) 断片(c)はσ因子(転写因子)であるFecIと相互作用することでFecIを活性化し、Fecシステム構成遺伝子の転写を誘導する。
3.RsePの新奇機能②:小さな膜タンパク質群の切断とその機能制御
これまでの研究から、RsePは膜外領域の小さな一回膜貫通タンパク質を認識して切断するとのモデルが提唱されています(6, 7)。そこで筆者らは、膜外領域が小さな、全長約50アミノ酸残基以下の小さな一回膜貫通タンパク質群であるSMP(Small Membrane Protein)に着目し、RsePがSMPを切断するかを検証しました。SMPはその小ささ故に解析が困難であり、これまで解析の進んでいないタンパク質群です。しかしながら、近年におけるゲノムワイドな解析技術の目覚ましい進歩によって、多数のSMPが細胞内で発現していることが確認されつつあります。さらにSMPはシグナル伝達や膜輸送の制御など、重要な生理機能を持つことも見出されており、注目を浴びています(8)。筆者らは多数のSMPをクローニングし、RsePによって切断を受けるかを網羅的にスクリーニングしました。その結果、調べた37種類のうち12種類ものSMPがRsePによって切断されうることを突き止めました。加えて、生細胞内・試験管内の両面からRsePによるSMPの切断反応を詳細に解析し、RsePが実際にSMPを切断することを強く示唆しました。
しかしながら、RsePによるこれらSMPの切断が、細胞にとってどのような意義があるかは不明でした。そこで筆者らは、これらの中でもHokBと呼ばれるSMPに着目しました。HokBはトキシン、すなわち、毒性を持つ内在性のタンパク質です。HokBは膜に挿入されると、膜中で多量体化し、膜に小さな孔を形成します。この小孔は、細胞の主要な「エネルギー源」であるATPのような小分子を細胞外に漏出させることで細胞の生理機能を低下させ、細胞毒性を発揮します。筆者らはRsePがHokBを切断することで、このようなHokBの機能を抑制する可能性を考え、RsePとHokBの発現が細胞の生育や細胞内ATP濃度にどのような影響を及ぼすかを調べました。その結果、RsePがHokBを切断することで、HokB小孔からのATP漏出等を抑制し、細胞毒性を抑制することを明らかにしました。これらの結果は、RsePがSMPを切断することで、その機能を制御しうることを示すものです(2)(図3)。
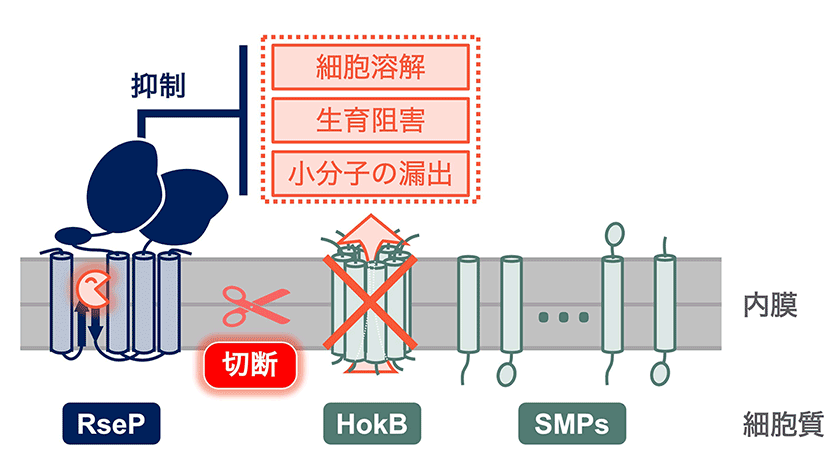
図3.RsePはHokBを含む多数のSMPを切断し、その機能を制御しうる
RsePはHokBをはじめとして多様なSMPを切断する。本研究では、RsePがHokBの切断を介してHokBが有する3つの機能(小分子の漏出・生育阻害・細胞溶解)等を抑制することを示した。
4.おわりに
以上のように、筆者らは異なる2つのアプローチから大腸菌RsePの未同定機能を探索し、RsePが、①FecRの切断を介して細胞の鉄取り込みの制御に関与すること、②HokBを含む多数のSMPを切断し、それら膜タンパク質の機能を制御しうることを明らかにしました。しかしながら、これらの研究を進める中で、新たな疑問も数多く生まれました。例えば、RsePの機能不全に伴って、Fecシステム以外にも様々なタンパク質の蓄積量が変化することを筆者らは見出していますが、その原因は不明です。RsePはこれまでの研究で明らかにした以外にも、未知の切断基質・細胞機能を有している可能性があります。また、筆者らはRsePがHokBの機能を抑制することを明らかにしましたが、HokBの機能を抑制することが、細胞の生存戦略上、どのような意味を持つかは明らかにできていません。HokBは近年、細菌のパーシスター化に関わると報告が続いています(9)。パーシスターとは細胞集団が抗生物質に曝されるなど致死的な環境にあっても生存し続けるごく一部の細胞であり、抗菌薬によって完全に排除することが難しいため、感染の慢性化を引き起こすことが知られています。RsePはHokBの切断を介して、細胞のパーシスター状態に関与する可能性もあります。
今後はこれらの新たな課題への取り組みも視野に入れながら、細菌が過酷な外界環境に適応する興味深い分子システムを対象として、細胞表層タンパク質の動態研究を進めていきます。
参考文献
- Yokoyama, T. et al. (2021) J Biol Chem. 296, 100673
- Yokoyama, T. et al. (2023) mBio. e0108623
- Brown, M. S. et al. (2000) Cell. 100, 391–8
- Kanehara, K. et al. (2002) Genes Dev. 16, 2147–2155
- Saito, A. et al. (2011) Proc Natl Acad Sci U S A. 108, 13740–13745
- Hizukuri, Y. et al. (2014) Structure. 22, 326–336
- Imaizumi, Y. et al. (2022) Sci Adv. 8, 9011
- Hemm, M. R. et al. (2020) EcoSal Plus. 9:1128/ecosalplus.ESP-0031–2019
- Verstraeten, N. et al. (2015) Mol Cell. 59, 9–21
横山 達彦 NAIST Edge BIO, 0017. (2023)

