研究成果の紹介
細胞が生み出す力を形の情報を用いて、高精度で推定する技術を開発
~がん、免疫、神経発達など細胞変形が係わる研究への応用が期待~
細胞が生み出す力を形の情報を用いて、高精度で推定する技術を開発
~がん、免疫、神経発達など細胞変形が係わる研究への応用が期待~
【概要】
奈良先端科学技術大学院大学(学長:塩﨑一裕)データ駆動型サイエンス創造センターの作村諭一 教授(兼:先端科学技術研究科 バイオサイエンス領域 データ駆動型生物学研究室)は、先端科学技術研究科 バイオサイエンス領域の稲垣直之教授、情報科学領域の池田和司教授、山口大学大学院創成科学研究科 理学系学域の岩楯好昭教授らとの共同研究により、細胞が体内で変形して移動するな ど物理的に変化するときに、細胞が生み出す機械的力の推定精度を向上する技術開発に成功しました。
細胞の力は直接計測することができないため、細胞の形の変化により生じた培養基質の変形量から推定されます。これまでの推定アルゴリズムは基質の変形のみから力を推定することが主流であり、これは細胞の力に対する反作用を測定する基質の応力(注 1)の推定に近いものでした。その結果、細胞が生み出した力としての推定の精度は決して良いとは言えませんでした。
本研究は、「あくまで細胞が力を出して基質を変形する」という事実を重視し、その力を推定する際に、基質の変形情報だけでなく、細胞自体の形状に関する情報によるバイアス(制約)を導入し、ベイズ統計学習(注 2)という統計学の手法によって精度の良い力推定を実現しました。精度の良い細胞の力が推定されることにより、細胞や組織の変形など、力学的な要素を含む生命現象の原理の解明に役立ちます。例えば、がん細胞や免疫細胞、発達中の神経細胞などのデータに応用可能で、医学や生物学の発展に寄与することが期待されます。
本研究は、国立研究開発法人日本医療研究開発機構(AMED)の革新的先端研究開発支援事業(AMED- CREST)「メカノバイオロジー機構の解明による革新的医療機器及び医療技術の創出」研究開発領域における研究開発課題「細胞-基質間の力を基盤とした細胞移動と神経回路形成機構の解明およびその破綻による病態の解明」(研究開発代表者:稲垣直之)および文部科学省 科学研究費補助金 学術変革領域(A)学術変革研究「力が制御する生体秩序の創発」研究開発領域における研究開発課題「定量細胞モデルによる血管新生の秩序力学の解明」(代表者:作村諭一)による支援によって実施しました。
こ の 研 究 成 果 は 、 2023 年 11 月 1 日 付 で 、 Biophysical Journal オ ン ラ イ ン 版
(https://doi.org/10.1016/j.bpj.2023.10.032)に掲載されました。
【解説】
細胞は柔軟に変形し移動します。発達中の細胞は適切な場所に移動して個別の細胞種に分化し、発達後は免疫細胞やがん細胞が体中を移動します。細胞のみならず、あらゆる物体の変形や移動には必ず機械的な力が関わっており、逆に力なしには変形や移動はできません。私たちが頭で念じただけで
移動できないように、細胞内で特定の分子が活性化しただけでは移動できません。したがって細胞の変形や移動に係る研究には機械的力を知ることが極めて重要です。
しかし、細胞の特定の部位で力を発生させた時、その力を直接計測することはできません。間接的な情報を用いて力を推定するしかありません。人は地面を足で押すことで前進する力を得ます。同様に、細胞も接着している培養基質を押す(牽引力)ことで移動や変形をすることができます。ゆえに、力によって発生する基質の変形は、力に関する情報が豊富であると考えられます。
基質の変形は、牽引力顕微鏡(TFM、注 3)を用いて基質に埋め込まれた蛍光ビーズの位置の変位によって部分的に計測することができます(図 1)。しかし、ビーズが存在する部分でしか基質の変位を計測することができず、またビーズをきれいに配置することもできません。ビーズの密度を高くすると、基質の弾性特性(ヤング率など)を変えてしまうため、ビーズ密度には限界があります。以上から、問題は高密度ではないビーズ環境で得られる基質変形データから、どれだけ力推定の精度を向上できるかにあります。
細胞の力はビーズ変位から「制約付きで逆算(注 4)」することで推定します。ビーズの変位情報より推定すべき力の数が多いので、制約付きでなければ解くことができません。これまでのアルゴリズムは、力を大きくしない制約(Ridge 回帰)や力の発生数を多くしない(Lasso 回帰)といった制約を用いてきました(図 2A とB)。しかし、それらの方法は細胞が力を生むという事実が反映されていません。
本研究で作村教授らは、あくまで細胞が力を出して基質を変形するという事実を重視し、それを制約として力の逆算を行いました(図 2C)。細胞領域の外にある基質の変位は全て細胞が駆動した結果であるはずです。また、これまでの細胞生物学の研究により、細胞はほとんどの場合、エッジ付近で内向きに力を発生させることが分かっています。本研究では、そうした既知の知見を力推定に盛り込みました。最大の難問は、細胞が様々な形状を持つことにありました。それゆえに、これまで細胞形状を力推定に反映することがなされてきませんでした。本研究では、任意の細胞形状で妥当な内向きの力を数学的に定義することに成功し、力推定時の制約としてそれを導入しました。
ベイズ統計学習は、未知変数(ここでは力)の逆算で複雑な制約を導入できるアルゴリズムです。本研究ではベイズ統計に基づく機械学習を導入し、力推定を行いました。ベイズ統計により、ビーズの変位から推定される力に対し、作村教授らが導入した制約を適用することで、折衷案的な推定結果を得ることができます(図 3)。人工データ(注 5)を用いて力推定の精度評価を行ったところ、従来のアルゴリズムより精度が良いこと、従来のアルゴリズムは力を大きく過小評価すること、細胞が丸などの変形がない簡素な形状であると力推定精度が低下することが分かりました。また、実際の細胞
(神経細胞の成長円錐、細胞性粘菌、ケラトサイト)の TFM 画像で力推定を行ったところ、従来のアルゴリズムでは推定されないような力を本研究のアルゴリズムで推定できることが分かりました。
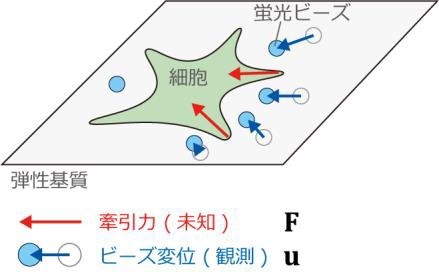
(図 1)細胞が生成した力(赤)により弾性基質が変形する。
基質の変形を蛍光ビーズの変位で部分的に観測する。
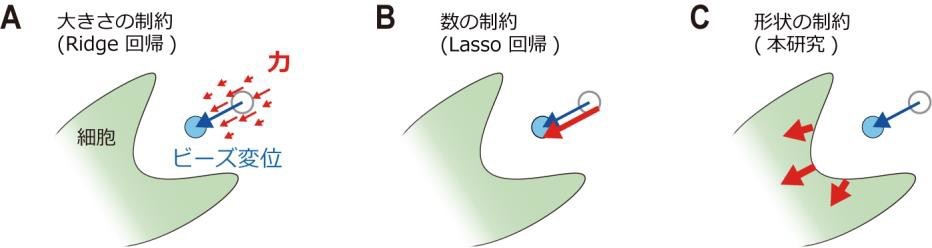
(図 2)ビーズの変位(青)から力(赤)を推定するための制約。(A) 力の大きさをなるべく小さくする制約。(B) 力が発生する場所をなるべく少なくする制約。
(C) 力の発生場所を細胞領域にし、その方向を内向きにする制約(本研究)。
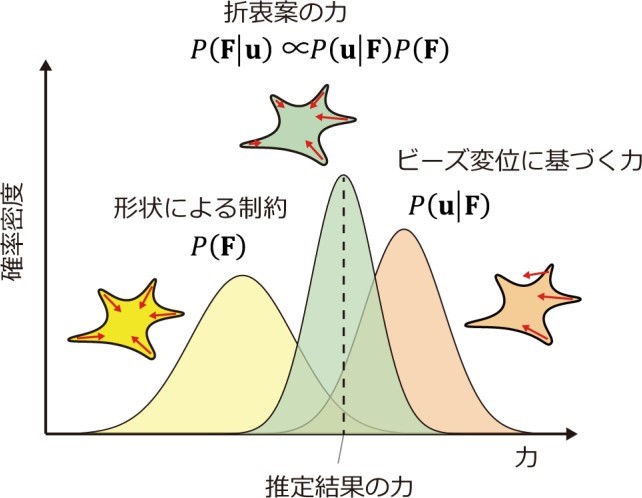
(図 3)細胞の形状に基づいた制約を加えることで、ビーズ変位からの力推定の精度をあげる。
ベイズ統計により、両方の要請を満たす最適な力を推定できる。
【今後の展開】
本研究で得られた力推定アルゴリズムにより、細胞の力をより正確に推定でき、細胞の変形や移動の原理解明に大きく寄与できることが期待できます。例えば細胞が力を感知することで濃縮する分子の動態や、細胞移動時の力の使い方などが明らかになります。
【用語解説】
注 1)基質の応力:ゴムやバネを引っ張ると反作用の力を生むように、弾力性のある培養基質に対して力を与えるとその力と反対方向に反作用の力を発生させる。物質の内部で発生するそのような力を応力という。
注 2)ベイズ統計学習:1 回のコイン投げで「表」が出ても、人は表が出る確率を 1 とは考えない。このように、見たものだけでなく過去の知識などを反映させて確率論的に推定する学習アルゴリズム。注 3)牽引力顕微鏡(Traction force microscopy 、TFM):ゲルなどの弾性基質に微小な蛍光ビーズを組み込み、その上で細胞を培養することで、細胞によって行われた基質の変形をビーズの変位によ って計測する技術。
注 4)制約付きで逆算:2 変数 x とy は少なくとも 2 個の式 ax + by = c、dx + ey = f があって解くことができるが、式が 1 個だけでは解くことができない。しかし、もし 1 個の式 ax + by = c しかないとき、別の式でx とy の条件を絞る(制約する)と、解くことができる。
注 5)人工データ:基質の変形を数理モデルで記述し、コンピュータ内で細胞の力を発生させて基質の変形データを作成した。正解(ここでは力)が分からない現象において、アルゴリズムの性能を評価するために用いられる。
【論文情報】
タイトル: Bayesian traction force estimation using cell boundary-dependent force priors
著者名: Ryosuke Fujikawa, Chika Okimura, Satoshi Kozawa, Kazushi Ikeda, Naoyuki Inagaki, Yoshiaki Iwadate, Yuichi Sakumura*
*責任著者
雑誌名: Biophysical Journal
DOI:https://doi.org/10.1016/j.bpj.2023.10.032
【データ駆動型生物学研究室】
研究室紹介ページ:https://bsw3.naist.jp/courses/courses311.html
研究室ホームページ:http://ncb.naist.jp/
(2023年11月15日掲載)
